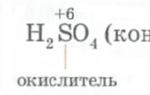Основные физические свойства олова. Химический элемент олово
Олово получают из руд или обогащенного металлом песка. Таковой имеется в морях Заполярья. Смесь гранул с высоким содержанием олово добывают прямо со дна моря Лаптевых. Извлечение породы ведется с помощью специализированных судов в районе Ванькиной губы. Первую партию песка подняли на поверхность еще в 1976-ом году.
Что такое олово?
Олово – металл. Он занимает 50-е место в таблице химических элементов Дмитрия Менделеева. 50-ый номер находится в 4-ой группе таблице, в ее главной подгруппе. Они входят в пятый период списка. Масса олова равна 118, 710.
Металл редкий и рассеянный. Его в небольших количествах выделяют из руд и песков. По содержанию в коре Земли, олово занимает 47-е место среди химических элементов. Больше всего серебристо-белого металла в кассетирите. Это минерал. В нем олова почти 80%. Кстати, именно доля кассетирита велика в песках, поднимаемых со дна океана. Велика доля легкого металла и в оловянном колчедане, но он редко встречается в природе.
Физические и химические свойства олова
У элемента невысокая планка плавления. Предельная температура олова , при которой металл остается твердым — 231 градус Цельсия. Уже при 231,9 градусах элемент плавится. Эта цифра одинакова для обеих модификаций металла. Он бывает белый и серый. Темный оттенок элемент приобретает, переходя из металлического состояние в порошкообразное. Плотность порошка значительно ниже, она равна 5 850 граммов на кубический сантиметр. Этот показатель более чем на тысячу уступает плотности олова в металлическом состоянии.

В состояние порошка олово переходит только при низких температурах. Метаморфозу называют оловянной чумой. Из-за нее, к примеру, в 1912-ом погибла целая экспедиция. Отправленная на Северный полюс команда «Скотта» на половине пути осталась без горючего. Керосин вытек из баков. Они были из жести, но спайка была из олова. На холоде оно стало порошком и высыпалось из швов, а вместе с ним вылилось и горючее.
Плавление олова сильно разнится с планкой кипения. Последняя составляет 2 270-ти градусах. Элемент легко гнется и в охлажденном состоянии, а при небольшом нагреве становится словно пластилин. Металл легкий, его вес сравним с алюминием.

Металл покрывает оксид олова . Он образует пленку, защищающую элемент от коррозии. Это свойство олово не теряет даже во влажном воздухе с температурой в 100 градусов Цельсия.
Олово не из списка химически стойких металлов. Оно вступает в реакцию, к примеру, с азотной и серной кислотами. Реагирует олово и с галогенами.
Применение олова
Люди нашли применение олову еще до нашей эры. Белесый металл служит человечеству приблизительно с бронзового века. Он назван так в честь сплава, изделия из которого были ведущими в указанную эпоху. Причем здесь олово? Оно входило в состав бронзы. Тогда это был сплав олова и меди . Такова рецептура и сейчас. Правда, теперь иногда добавляют еще алюминий, кремний и свинец. Да и роль бронзы в жизни общества уже не та.
В 21-ом веке легкий металл используют не только для бронзы, но и для припоев. На эти цели идет обычно сплав олова и свинца . Используют также соединения с кадмием и висмутом. Такие составы не рассыплются в порошок даже на холоде, поэтому служат надежной «соединительной тканью» для различных деталей.

Сплав олова со свинцом и сурьмой используют в печатной промышленности. Соединение трех элементов идет на создание типографских шрифтов.
Оловом прокатывают фольгу. Из белого металла делают трубы и прочие элементы, которые должны обладать антикоррозийными свойствами. Поскольку олово не ржавеет, из него делают посуду. Пищевой металл отлично проводит тепло. Элемент не токсичен. Его применяют даже для покрытий емкостей для длительного хранения еды, к примеру, для консервных банок. Кстати, банки покрывают оловом и снаружи. Так всегда поступают с жестяной тарой, что уберегает ее от разрушения.
Посуду из олова делали и в древности. Наши предки также заметили особенность олова не поддаваться коррозии, не ржаветь. Однако, столовые приборы из легкого металла не были распространены. Причина – дороговизна. В прошлые эпохи олово стоило наравне с золотом и даже больше. Так, даже у знатных римлян олово не всегда было в изобилии.

Олово – важный элемент тканевой промышленности. Здесь в ход идут соли металла. Они используются при изготовлении натурального шелка и печатании на ситцевых материях. Белесый элемент пригождается и в медицине. Олово нужно стоматологам для формирования некоторых пломб. Сейчас они отходят в прошлое, но раньше составляли чуть ли не 100% всех зубных «заплаток». Раньше олово применялось и при лечении эпилепсии. Припадки снимали с помощью пилюль из олова и хлора. Этим же способом боролись со многими неврозами. Звучит страшно, но олово содержится в организме человека и без пилюль. Более того, элемент необходим. При его нехватке замедляется, к примеру, рост людей.
Купить металл для тех или иных нужд можно примерно за 1 000 рублей. Это олово , цена на которое установлена с учетом обработки. Тысячу просят за пруты, цилиндры и прочие готовые элементы. Чистое олово купить можно гораздо дешевле, в среднем на 30-40%. Еще бюджетнее порошок металла. Его, к слову, добавляют в инсектицидные смеси. Так называются химические составы для травли насекомых, к примеру, вредителей сада и огорода. Олова боятся и морские «вредители». Так, на покрытое белым металлом дно кораблей не присасываются моллюски, не разрушая тем самым конструкцию.
Олово – один из немногих металлов, известных человеку еще с доисторических времен. Олово и медь были открыты раньше железа, а сплав их, бронза, – это, по-видимому, самый первый «искусственный» материал, первый материал, приготовленный человеком.
Результаты археологических раскопок позволяют считать, что еще за пять тысячелетий до нашей эры люди умели выплавлять и само олово. Известно, что древние египтяне олово для производства бронзы возили из Персии.
Под названием «трапу» этот металл описан в древнеиндийской литературе. Латинское название олова stannum происходит от санскритского «ста», что означает «твердый».
Упоминание об олове встречается и у Гомера. Почти за десять веков до новой эры финикияне доставляли оловянную руду с Британских островов, называвшихся тогда Касситеридами. Отсюда название касситерита – важнейшего из минералов олова; состав его SnO 2 . Другой важный минерал – станнин, или оловянный колчедан, Cu 2 FeSnS 4 . Остальные 14 минералов элемента №50 встречаются намного реже и промышленного значения не имеют. Между прочим, наши предки располагали более богатыми оловянными рудами, чем мы. Можно было выплавлять металл непосредственно из руд, находящихся на поверхности Земли и обогащенных в ходе естественных процессов выветривания и вымывания. В наше время таких руд уже нет. В современных условиях процесс получения олова многоступенчатый и трудоемкий. Руды, из которых выплавляют олово теперь, сложны по составу: кроме элемента №50 (в виде окисла или сульфида) в них обычно присутствуют кремний, железо, свинец, медь, цинк, мышьяк, алюминий, кальций, вольфрам и другие элементы. Нынешние оловянные руды редко содержат больше 1% Sn, а россыпи – и того меньше: 0,01...0,02% Sn. Это значит, что для получения килограмма олова необходимо добыть и переработать по меньшей мере центнер руды.
Как получают олово из руд
Производство элемента №50 из руд и россыпей всегда начинается с обогащения. Методы обогащения оловянных руд довольно разнообразны. Применяют, в частности, гравитационный метод, основанный на различии плотности основного и сопутствующих минералов. При этом нельзя забывать, что сопутствующие далеко не всегда бывают пустой породой. Часто они содержат ценные металлы, например вольфрам, титан, лантаноиды. В таких случаях из оловянной руды пытаются извлечь все ценные компоненты.
Состав полученного оловянного концентрата зависит от сырья, и еще от того, каким способом этот концентрат получали. Содержание олова в нем колеблется от 40 до 70%. Концентрат направляют в печи для обжига (при 600...700°C), где из него удаляются относительно летучие примеси мышьяка и серы. А большую часть железа, сурьмы, висмута и некоторых других металлов уже после обжига выщелачивают соляной кислотой. После того как это сделано, остается отделить олово от кислорода и кремния. Поэтому последняя стадия производства чернового олова – плавка с углем и флюсами в отражательных или электрических печах. С физико-химической точки зрения этот процесс аналогичен доменному: углерод «отнимает» у олова кислород, а флюсы превращают двуокись кремния в легкий по сравнению с металлом шлак.
В черновом олове примесей еще довольно много: 5...8%. Чтобы получить металл сортовых марок (96,5...99,9% Sn), используют огневое или реже электролитическое рафинирование. А нужное полупроводниковой промышленности олово чистотой почти шесть девяток – 99,99985% Sn – получают преимущественно методом зонной плавки.
Еще один источник
Для того чтобы получить килограмм олова, не обязательно перерабатывать центнер руды. Можно поступить иначе: «ободрать» 2000 старых консервных банок.
Всего лишь полграмма олова приходится на каждую банку. Но помноженные на масштабы производства эти полуграммы превращаются в десятки тонн... Доля «вторичного» олова в промышленности капиталистических стран составляет примерно треть общего производства. В нашей стране работают около ста промышленных установок по регенерации олова.
Как же снимают олово с белой жести? Механическими способами сделать это почти невозможно, поэтому используют различие в химических свойствах железа и олова. Чаще всего жесть обрабатывают газообразным хлором. Железо в отсутствие влаги с ним не реагирует. Олово же соединяется с хлором очень легко. Образуется дымящаяся жидкость – хлорное олово SnCl 4 , которое применяют в химической и текстильной промышленности или отправляют в электролизер, чтобы получить там из него металлическое олово. И опять начнется «круговерть»: этим оловом покроют стальные листы, получат белую жесть. Из нее сделают банки, банки заполнят едой и запечатают. Потом их вскроют, консервы съедят, банки выбросят. А потом они (не все, к сожалению) вновь попадут на заводы «вторичного» олова.
Другие элементы совершают круговорот в природе с участием растений, микроорганизмов и т.д. Круговорот олова – дело рук человеческих.
Олово в сплавах
На консервные банки идет примерно половина мирового производства олова. Другая половина – в металлургию, для получения различных сплавов. Мы не будем подробно рассказывать о самом известном из сплавов олова – бронзе, адресуя читателей к статье о меди – другом важнейшем компоненте бронз. Это тем более оправдано, что есть безоловянные бронзы, но нет «безмедных». Одна из главных причин создания безоловянпьтх бронз – дефицитность элемента №50. Тем не менее бронза, содержащая олово, по-прежнему остается важным материалом и для машиностроения, и для искусства.
Техника нуждается и в других оловянных сплавах. Их, правда, почти не применяют в качестве конструкционных, материалов: они недостаточно прочны и слишком дороги. Зато у них есть другие свойства, позволяющие решать важные технические задачи при сравнительно небольших затратах материала.
Чаще всего оловянные сплавы применяют в качестве антифрикционных материалов или припоев. Первые позволяют сохранять машины и механизмы, уменьшая потери на трение; вторые соединяют металлические детали.
Из всех антифрикционных сплавов наилучшими свойствами обладают оловянные баббиты, в составе которых до 90% олова. Мягкие и легкоплавкие свинцовооловянные припои хорошо смачивают поверхность большинства металлов, обладают высокой пластичностью и сопротивлением усталости. Однако область их применения ограничивается из-за недостаточной механической прочности самих припоев.
Олово входит также в состав типографского сплава гарта. Наконец, сплавы на основе олова очень нужны электротехнике. Важнейший материал для электроконденсаторов – станиоль; это почти чистое олово, превращенное в тонкие листы (доля других металлов в станиоле не превышает 5%).
Между прочим, многие сплавы олова – истинные химические соединения элемента №50 с другими металлами. Сплавляясь, олово взаимодействует с кальцием, магнием, цирконием, титаном, многими редкоземельными элементами. Образующиеся при этом соединения отличаются довольно большой тугоплавкостью. Так, станнид циркония Zr 3 Sn 2 плавится лишь при 1985°C. И «виновата» здесь не только тугоплавкость циркония, но и характер сплава, химическая связь между образующими его веществами. Или другой пример. Магний к числу тугоплавких металлов не отнесешь, 651°C – далеко не рекордная температура плавления. Олово плавится при еще более низкой температуре – 232°C. А их сплав – соединение Mg 2 Sn – имеет температуру плавления 778°C.
Тот факт, что элемент №50 образует довольно многочисленные сплавы такого рода, заставляет критически отнестись к утверждению, что лишь 7% производимого в мире олова расходуется в виде химических соединений («Краткая химическая энциклопедия», т. 3, с. 739). Видимо, речь здесь идет только о соединениях с неметаллами.
Соединения с неметаллами
Из этих веществ наибольшее значение имеют хлориды. В тетрахлориде олова SnCl 4 растворяются иод, фосфор, сера, многие органические вещества. Поэтому и используют его главным образом как весьма специфический растворитель. Дихлорид олова SnCl 2 применяют как протраву при крашении и как восстановитель при синтезе органических красителей. Те же функции в текстильном производстве еще у одного соединения элемента №50 – станната натрия Na 2 SnO 3 . Кроме того, с его помощью утяжеляют шелк.
Промышленность ограниченно использует и окислы олова. SnO применяют для получения рубинового стекла, a SnO 2 – белой глазури. Золотисто-желтые кристаллы дисульфида олова SnS 2 нередко называют сусальным золотом, которым «золотят» дерево, гипс. Это, если можно так выразиться, самое «антисовременное» применение соединений олова. А самое современное?
Если иметь в виду только соединения олова, то это применение станната бария BaSnO 3 в радиотехнике в качестве превосходного диэлектрика. А один из изотопов олова, 119 Sn, сыграл заметную роль при изучении эффекта Мессбауэра – явления, благодаря которому был создан новый метод исследования – гамма-резонансная спектроскопия. И это не единственный случай, когда древний металл сослужил службу современной науке.
На примере серого олова – одной из модификаций элемента №50 – была выявлена связь между свойствами и химической природой полупроводникового материала. И это, видимо, единственное, за что серое олово можно помянуть добрым словом: вреда оно принесло больше, тем пользы. Мы еще вернемся к этой разновидности элемента №50 после рассказа о еще одной большой и важной группе соединений олова.
Об оловоорганике
Элементоорганических соединений, в состав которых входит олово, известно великое множество. Первое из них получено еще в 1852 г.
Сначала вещества этого класса получали лишь одним способом – в обменной реакции между неорганическими соединениями олова и реактивами Гриньяра. Вот пример такой реакции:
SnCl 4 + 4RMgX → SnR 4 + 4MgXCl
(R здесь – углеводородный радикал, X – галоген).
Соединения состава SnR 4 широкого практического применения не нашли. Но именно из них получены другие оловоорганические вещества, польза которых несомненна.
Впервые интерес к оловоорганике возник в годы первой мировой войны. Почти все органические соединения олова, полученные к тому времени, были токсичны. В качестве отравляющих веществ эти соединения не были использованы, их токсичностью для насекомых, плесневых грибков, вредных микробов воспользовались позже. На основе ацетата трифенилолова (C 6 H 5) 3 SnOOCCH 3 был создан эффективный препарат для борьбы с грибковыми заболеваниями картофеля и сахарной свеклы. У этого препарата оказалось еще одно полезное свойство: он стимулировал рост и развитие растений.
Для борьбы с грибками, развивающимися в аппаратах целлюлозно-бумажной промышленности, применяют другое вещество – гидроокись трибутилолова (С 4 Н 9) 3 SnOH. Это намного повышает производительность аппаратуры.
Много «профессий» у дилаурината дибутилолова (C 4 H 9) 2 Sn(OCOC 11 H 23) 2 . Его используют в ветеринарной практике как средство против гельминтов (глистов). Это же вещество широко применяют в химической промышленности как стабилизатор поливинилхлорида и других полимерных материалов и как катализатор. Скорость реакции образования уретанов (мономеры полиуретановых каучуков) в присутствии такого катализатора возрастает в 37 тыс. раз.
На основе оловоорганических соединений созданы эффективные инсектициды; оловоорганические стекла надежно защищают от рентгеновского облучения, полимерными свинец- и оловоорганическими красками покрывают подводные части кораблей, чтобы на них не нарастали моллюски.
Все это соединения четырехвалентного олова. Ограниченные рамки статьи не позволяют рассказать о многих других полезных веществах этого класса.
Органические соединения двухвалентного олова, напротив, немногочисленны и практического применения пока почти не находят.
О сером олове
Морозной зимой 1916 г. партия олова была отправлена по железной дороге с Дальнего Востока в европейскую часть России. Но на место прибыли не серебристо-белые слитки, а преимущественно мелкий серый порошок.
За четыре года до этого произошла катастрофа с экспедицией полярного исследователя Роберта Скотта. Экспедиция, направлявшаяся к Южному полюсу, осталась без топлива: оно вытекло из железных сосудов сквозь швы, пропаянные оловом.
Примерно в те же годы к известному русскому химику В.В. Марковникову обратились из интендантства с просьбой объяснить, что происходит с лужеными чайниками, которыми снабжали русскую армию. Чайник, который принесли в лабораторию в качестве наглядного примера, был покрыт серыми пятнами и наростами, которые осыпались даже при легком постукивании рукой. Анализ показал, что и пыль, и наросты состояли только из олова, без каких бы то ни было примесей.
Что же происходило с металлом во всех этих случаях?
Как и многие другие элементы, олово имеет несколько аллотропических модификаций, несколько состояний. (Слово «аллотропия» переводится с греческого как «другое свойство», «другой поворот».) При нормальной плюсовой температуре олово выглядит так, что никто не может усомниться в принадлежности его к классу металлов.
Белый металл, пластичный, ковкий. Кристаллы белого олова (его называют еще бета-оловом) тетрагональные. Длина ребер элементарной кристаллической решетки – 5,82 и 3,18 Å. Но при температуре ниже 13,2°C «нормальное» состояние олова иное. Едва достигнут этот температурный порог, в кристаллической структуре оловянного слитка начинается перестройка. Белое олово превращается в порошкообразное серое, или альфа-олово, и чем ниже температура, тем больше скорость этого превращения. Максимума она достигает при минус 39°C.
Кристаллы серого олова кубической конфигурации; размеры их элементарных ячеек больше – длина ребра 6,49 Å. Поэтому плотность серого олова заметно меньше, чем белого: 5,76 и 7,3 г/см 3 соответственно.
Результат превращения белого олова в серое иногда называют «оловянной чумой». Пятна и наросты на армейских чайниках, вагоны с оловянной пылью, швы, ставшие проницаемыми для жидкости, – следствия этой «болезни».
Почему сейчас не случаются подобные истории? Только по одной причине: оловянную чуму научились «лечить». Выяснена ее физико-химическая природа, установлено, как влияют на восприимчивость металла к «чуме» те или иные добавки. Оказалось, что алюминий и цинк способствуют этому процессу, а висмут, свинец и сурьма, напротив, противодействуют ему.
Кроме белого и серого олова, обнаружена еще одна аллотропическая модификация элемента №50 – гамма-олово, устойчивое при температуре выше 161°C. Отличительная черта такого олова – хрупкость. Как и все металлы, с ростом температуры олово становится пластичнее, но только при температуре ниже 161°C. Затем оно полностью утрачивает пластичность, превращаясь в гамма-олово, и становится настолько хрупким, что его можно истолочь в порошок.
Еще раз о дефиците
Часто статьи об элементах заканчиваются рассуждениями автора о будущем своего «героя». Как правило, рисуется оно в розовом свете. Автор статьи об олове лишен этой возможности: будущее олова – металла, несомненно, полезнейшего – неясно. Неясно только по одной причине.
Несколько лет назад американское Горное бюро опубликовало расчеты, из которых следовало, что разведанных запасов элемента №50 хватит миру самое большее на 35 лет. Правда, уже после этого было найдено несколько новых месторождений, в том числе крупнейшее в Европе, расположенное на территории Польской Народной Республики. И тем не менее дефицит олова продолжает тревожить специалистов.
Поэтому, заканчивая рассказ об элементе №50, мы хотим еще раз напомнить о необходимости экономить и беречь олово.
Нехватка этого металла волновала даже классиков литературы. Помните у Андерсена? «Двадцать четыре солдатика были совершенно одинаковые, а двадцать пятый солдатик был одноногий. Его отливали последним, и олова немного не хватило». Теперь олова не хватает не немного. Недаром даже двуногие оловянные солдатики стали редкостью – чаще встречаются пластмассовые. Но при всем уважении к полимерам заменить олово они могут далеко не всегда.
Изотопы
Олово – один из самых «многоизотопных» элементов: природное олово состоит из десяти изотопов с массовыми числами 112, 114...120, 122 и 124. Самый распространенный из них 120 Sn, на его долю приходится около 33% всего земного олова. Почти в 100 раз меньше олова-115 – самого редкого изотопа элемента №50. Еще 15 изотопов олова с массовыми числами 108...111, 113, 121, 123, 125...132 получены искусственно. Время жизни этих изотопов далеко не одинаково. Так, олово-123 имеет период полураспада 136 дней, а олово-132 всего 2,2 минуты.
Почему бронзу назвали бронзой?
Слово «бронза» почти одинаково звучит на многих европейских языках. Его происхождение связывают с названием небольшого итальянского порта на берегу Адриатического моря – Бриндизи. Именно через этот порт доставляли бронзу в Европу в старину, и в древнем Риме этот сплав называли «эс бриндиси» – медь из Бриндизи.
В честь изобретателя
Латинское слово frictio означает «трение». Отсюда название антифрикционных материалов, то есть материалов «против трения». Они мало истираются, отличаются мягкостью и тягучестью. Главное их применение – изготовление подшипниковых вкладышей. Первый антифрикционный сплав на основе олова и свинца предложил в 1839 г. инженер Баббит. Отсюда название большой и очень важной группы антифрикционных сплавов – баббитов.
Жесть для консервирования
Способ длительного сохранения пищевых продуктов консервированием в банках из белой жести, покрытой оловом, первым предложил французский повар Ф. Аппер в 1809 г.
Со дна океана
В 1976 г. начало работать необычное предприятие, которое сокращенно называют РЭП. Расшифровывается это так: разведочно-эксплуатационное предприятие. Оно размещается в основном на кораблях. За Полярным кругом, в море Лаптевых, в районе Ванькиной губы РЭП добывает с морского дна оловоносный песок. Здесь же, на борту одного из судов, работает обогатительная фабрика.
Мировое производство
По американским данным, мировое производство олова в 1975 г. составляло 174...180 тыс. т.
Химический элемент олово является одним из семи древних металлов, которые известны человечеству. Этот металл входит в состав бронзы, имеющей огромное значение. В настоящее время химический элемент олово утратил востребованность, но его свойства заслуживают детального рассмотрения и изучения.
Что собой представляет элемент
Располагается он в пятом периоде, в четвертой группе (главной подгруппе). Подобное расположение свидетельствует о том, что химический элемент олово - амфотерное соединение, способное проявлять и основные, и кислотные свойства. Относительная атомная масса составляет 50, поэтому его считают легким элементом.
Особенности
Химический элемент олово является пластичным, ковким, легким веществом серебристого белого цвета. По мере эксплуатации он теряет свой блеск, что считают минусом его характеристик. Олово - металл рассеянный, поэтому существуют сложности с его добычей. Элемент имеет высокую температуру кипения (2600 градусов), низкую температуру плавления (231,9 С), большую электрическую проводимость, отличную ковкость. У него высокое сопротивление разрыву.
Олово - элемент, который не обладает токсичными свойствами, не оказывает негативного воздействия на организм человека, поэтому востребован в пищевом производстве.
Какое еще имеет свойство олово? При выборе данного элемента для изготовления посуды и водного трубопровода не придется опасаться за свою безопасность.

Нахождение в организме
Чем еще характеризуется олово (химический элемент)? Как читается его формула? Данные вопросы рассматриваются в курсе школьной программы. В нашем организме данный элемент располагается в костях, способствуя процессу регенерации костной ткани. Его относят к макроэлементам, поэтому для полноценной жизнедеятельности, человеку достаточно от двух до десяти мг олова в сутки.
В организм этот элемент попадает в большем количестве с пищей, но кишечник усваивает не больше пяти процентов поступлений, поэтому вероятность отравления минимальна.
При недостатке данного металла происходит замедление роста, происходит потеря слуха, меняется состав костной ткани, наблюдается облысение. Отравление вызывается поглощением пыли или паров данного металла, а также его соединений.

Основные свойства
Плотность олова имеет среднюю величину. Металл отличается высокой коррозионной стойкостью, поэтому его применяют в народном хозяйстве. Например, олово востребовано при изготовлении консервных банок.
Чем еще характеризуется олово? Применение этого металла основывается также на его способности объединять различные металлы, создавая устойчивую к агрессивным средам, внешнюю среду. Например, сам металл необходим для лужения предметов быта и посуды, а его припои нужны для радиотехники и электричества.
Характеристики
По своим внешним характеристикам этот металл аналогичен алюминию. В реальности сходство между ними незначительное, ограничивается только легкостью и металлическим блеском, устойчивостью к химической коррозии. Алюминий проявляется амфотерные свойства, поэтому легко вступает в реакцию со щелочами и кислотами.
Например, если на алюминий действует уксусная кислота, наблюдается химическое взаимодействие. Олово же способно взаимодействовать только с сильными концентрированными кислотами.

Преимущества и недостатки олова
Данный металл практически не используется в строительстве, поскольку не отличается высокой механической прочностью. В основном в настоящее время используют не чистый металл, а его сплавы.
Выделим основные преимущества данного металла. Особое значение имеет ковкость, ее используют в процессе изготовления предметов быта. Например, эстетично выглядят подставки, светильники, выполненные из данного металла.
Оловянное покрытие позволяет существенно снижать трение, благодаря чему изделие защищено от преждевременного износа.
Среди основных недостатков данного метала можно упомянуть его незначительную прочность. Олово непригодно для изготовления частей и деталей, предполагающих существенные нагрузки.

Добыча металла
Плавление олова осуществляется при невысокой температуре, но из-за трудности его добычи металл считается дорогостоящим веществом. Из-за низкой температуры плавления при нанесении олова на поверхность металла можно получить существенную экономию электрической энергии.
Структура
Металл имеет однородную структуру, но, в зависимости от температуры, возможны разные его фазы, отличающиеся по характеристикам. Среди самых распространенных модификаций данного металла отметим β-вариант, существующий при температуре 20 градусов. Теплопроводность, его температура кипения, являются основными характеристиками, приводимыми для олова. При снижении температуры от 13,2 С образуется α-модификация, именуемая серым оловом. Эта форма не обладает пластичностью и ковкостью, имеет меньшую плотность, поскольку обладает иной кристаллической решеткой.
При переходе из одной формы в другую наблюдается изменение объема, так как существует разница в плотности, в результате чего происходит разрушение оловянного изделия. Такое явление называют «оловянной чумой». Такая особенность приводит к тому, что существенно уменьшается область использования металла.
В природных условиях олово можно найти в составе горных пород в виде рассеянного элемента, кроме того известны его минеральные формы. Например, в касситерите содержится его оксид, а в оловянном колчедане - его сульфид.

Производство
Перспективными для промышленной переработки считают оловянные руды, в которых содержание металла не меньше 0,1 процента. Но в настоящее время эксплуатируют и те месторождения, в которых содержание металла составляет всего 0,01 процента. Для добычи минерала применяют различные способы, учитывая специфику месторождения, а также его разновидность.
В основном оловянные руды представлены в виде песков. Добыча сводится к его постоянной промывке, а также к концентрированию рудного минерала. Коренное месторождение разрабатывать гораздо сложнее, поскольку необходимы дополнительные сооружения, строительство и эксплуатация шахт.
Концентрат минерала перевозят на завод, специализирующийся на плавке цветного металла. Далее осуществляется многократное обогащение руды, измельчение, затем промывание. Рудный шлих восстанавливают, воспользовавшись специальными печами. Для полного восстановления олова этот процесс проводят несколько раз. На завершающем этапе осуществляют процесс очистки от примесей чернового олова, используя термический либо электролитический способ.
Использование
В качестве основной характеристики, позволяющей применять олово, выделяют его высокую коррозионную устойчивость. Данный металл, а также его сплавы являются одними из самых устойчивых соединений по отношению к агрессивным химическим веществам. Больше половины всего олова, производимого в мире, применяется для изготовления белой жести. Данную технологию, связанную с нанесением на сталь тонкого слоя олова, стали применять для защиты от химической коррозии консервных банок.
Способность олова к раскатыванию используется для производства из него тонкостенных труб. Из-за неустойчивости данного металла к низким значениям температур его бытовое использование достаточно ограничено.
У сплавов олова значение теплопроводности существенно ниже, чем у стали, поэтому их можно применять для производства умывальников и ванн, а также для изготовления различной сантехнической фурнитуры.
Олово подходит для производства незначительных декоративных и бытовых предметов, изготовления посуды, создания оригинальных ювелирных украшений. Этот неяркий и ковкий металл при объединении с медью давно стал одним из самых излюбленных материалов скульпторов. Бронза объединяет в себе высокую прочность, стойкость к химической и естественной коррозии. Этот сплав востребован в качестве декоративного и строительного материала.
Олово является тонально-резонансным металлом. Например, при его соединении со свинцом получают сплав, применяемый для изготовления современных музыкальных инструментов. С древних времен известны бронзовые колокола. Для создания органных труб применяют сплав олова со свинцом.

Заключение
Увеличение внимания современного производства к вопросам, связанным с охраной окружающей среды, а также к проблемам, связанным с сохранением здоровья населения, повлиял на состав материалов, применяемых в изготовлении электроники. Например, возрос интерес к технологии бессвинцового процесса пайки. Свинец является материалом, приносящим существенный вред здоровью человека, поэтому его перестали применять в электротехнике. Ужесточились требования к пайке, вместо опасного свинца стали использовать сплавы олова.
Чистое олово практически не используется в промышленности, поскольку возникают проблемы с развитием «оловянной чумы». Среди основных сфер применения данного редкого рассеянного элемента выделим изготовление сверхпроводящих проводов.
Покрытие чистым оловом контактных поверхностей позволяет увеличивать процесс пайки, защищать металл от процесса коррозии.
В результате перехода на бессвинцовую технологию многих производителей стали ими начало использоваться натуральное олово для покрытия контактных поверхностей и выводов. Подобный вариант позволяет по приемлемой стоимости получать качественное защитное покрытие. Благодаря отсутствию примесей, новая технология не только считается экологически безопасной, но и дает возможность получать отличный результат по приемлемой стоимости. Именно олово производители считают перспективным и современным металлом в электротехнике, радиоэлектронике.
Бром.1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5 .
Валентные электроны выделены жирным шрифтом. Относится к семейству р-элементов. Так как наибольшее главное квантовое число равно 4-м, а число электронов на внешнем энергетическом уровне равно 7, бром расположен в 4-м периоде, VIIA группе Периодической таблицы. Энергетическая диаграмма для валентных электронов имеет вид:
Германий.
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 2 .
Валентные электроны выделены жирным шрифтом. Относится к семейству p-элементов. Так как наибольшее главное квантовое число равно 4-м, а число электронов на внешнем энергетическом уровне равно 4, германий расположен в 4-м периоде, IVA группе Периодической таблицы. Энергетическая диаграмма для валентных электронов имеет вид:

Кобальт.
1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4s 2 .
Валентные электроны выделены жирным шрифтом. Относится к семейству d-элементов. Кобальт расположен в 4-м периоде, VIIB группе Периодической таблицы. Энергетическая диаграмма для валентных электронов имеет вид:

Медь.
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 .
Валентные электроны выделены жирным шрифтом. Относится к семейству d-элементов. Так как наибольшее главное квантовое число равно 4-м, а число электронов на внешнем энергетическом уровне равно 1, медь расположена в 4-м периоде, IВ группе Периодической таблицы. Энергетическая диаграмма для валентных электронов имеет вид.
Олово
- пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета. Используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (луженое железо) для изготовления тары, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов.Элемент состоит из 10 изотопов с массовыми числами 112, 114-120, 122, 124; последний слабо радиоактивен; изотоп 120 Sn наиболее распространен (около 33%).
Смотрите так же:
СТРУКТУРА
 Олово имеет две аллотропные модификации: a-Sn (серое олово) с гранецентрированной кубической кристаллической решеткой и b-Sn (обычное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Фазовый переход b -> a ускоряется при низких температурах (-30° С) и в присутствии зародышей кристаллов серого олова; известны случаи, когда оловянные изделия на морозе рассыпались в серый порошок («оловянная чума»), но это превращение даже при очень низких температурах резко тормозится наличием мельчайших примесей и поэтому редко встречается, представляя скорее научный, чем практический интерес.
Олово имеет две аллотропные модификации: a-Sn (серое олово) с гранецентрированной кубической кристаллической решеткой и b-Sn (обычное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Фазовый переход b -> a ускоряется при низких температурах (-30° С) и в присутствии зародышей кристаллов серого олова; известны случаи, когда оловянные изделия на морозе рассыпались в серый порошок («оловянная чума»), но это превращение даже при очень низких температурах резко тормозится наличием мельчайших примесей и поэтому редко встречается, представляя скорее научный, чем практический интерес.
СВОЙСТВА
 Плотность b-Sn 7,29 г/см 3 , плотность a-Sn 5.85 г/см 3 ,. Температура плавления 231,9°C, температура кипения 2270°C.
Плотность b-Sn 7,29 г/см 3 , плотность a-Sn 5.85 г/см 3 ,. Температура плавления 231,9°C, температура кипения 2270°C.
Температурный коэффициент линейного расширения 23·10 -6 (0-100 °С); удельная теплоемкость (0°С) 0,225 кдж/(кг·К), то есть 0,0536 кал/(г·°С); теплопроводность (0°С) 65,8 вт/(м·К.), то есть 0,157 кал/(см·сек·°С); удельное электрическое сопротивление (20 °С) 0,115·10 -6 ом·м, то есть 11,5·10 -6 ом·см. Серое олово является диамагнетиком, а белое — парамагнетиком.
Предел прочности при растяжении 16,6 Мн/м 2 (1,7 кгс/мм 2); относительное удлинение 80-90%; твердость по Бринеллю 38,3-41,2 Мн/м 2 (3,9-4,2 кгс/мм 2). При изгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов.
Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется.
ЗАПАСЫ И ДОБЫЧА
 Олово - редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2·10 −4 до 8·10 −3 % по массе. Основной минерал олова - касситерит (оловянный камень) SnO 2 , содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) - Cu 2 FeSnS 4 (27,5 % Sn). Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии - Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
Олово - редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2·10 −4 до 8·10 −3 % по массе. Основной минерал олова - касситерит (оловянный камень) SnO 2 , содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) - Cu 2 FeSnS 4 (27,5 % Sn). Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии - Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин - разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40-70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO 2 + C = Sn + CO 2 . Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
ПРОИСХОЖДЕНИЕ

Основная форма нахождения олова в горных породах и минералах - рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO 2) и сульфидной (станнин) формах.
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма: конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W - с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc - с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe +2: биотиты, гранаты, пироксены, магнетиты, турмалины и т. д. Эта связь обусловлена изоморфизмом, например, по схеме Sn +4 + Fe +2 → 2Fe +3 . В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес.%) (особенно в андрадитах), эпидотах (до 2,84 вес.%) и т. д.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu 2 +1 Fe +2 SnS 4 или тиллита PbSnS 2 и других минералов.
ПРИМЕНЕНИЕ
 Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова - в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова - бронза (с медью). Другой известный сплав - пьютер - используется для изготовления посуды. Для этих целей расходуется около 33 % всего добываемого олова. До 60 % производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb 3 Sn.
Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова - в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова - бронза (с медью). Другой известный сплав - пьютер - используется для изготовления посуды. Для этих целей расходуется около 33 % всего добываемого олова. До 60 % производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb 3 Sn.
Дисульфид олова SnS 2 применяют в составе красок, имитирующих позолоту («поталь»).
Искусственные радиоактивные ядерные изомеры олова 117m Sn и 119m Sn - источники гамма-излучения, являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
Двуокись олова - очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
Смесь солей олова - «жёлтая композиция» - ранее использовалась как краситель для шерсти.
Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
Исследуются изолированные двумерные слои олова (станен), созданные по аналогии с графеном.
Олово (англ. Tin) — Sn
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/A.05-30 |
| Nickel-Strunz (10-ое издание) | 1.AC.10 |
| Dana (7-ое издание) | 1.1.19.1 |
| Dana (8-ое издание) | 1.1.13.1 | Hey’s CIM Ref | 1.29 |