Соляная кислота медь
Опыт 1. Взаимодействие меди с кислотами
а) Поместите в пробирку немного стружек меди и прилейте 1-2 мл H 2 SO 4 (2н). Отметьте отсутствие изменений. Прилейте в пробирку несколько капель пероксида водорода (H 2 O 2) и слегка встряхните содержимое пробирки. Отметьте изменение окраски раствора и объясните происходящее явление. Напишите уравнение реакции.
Cu + H 2 SO 4 разб. ¹
Cu + H 2 SO 4 разб. + H 2 O 2 ® CuSO 4 + H 2 O
б) Поместите в две пробирки немного медных стружек (опыт проводите под тягой). В первую пробирку налейте немного концентрированной серной кислоты и нагрейте. Что наблюдаете? Напишите уравнение реакции. Во вторую пробирку прилейте немного концентрированной азотной кислоты HNO 3 . Что наблюдаете? Напишите уравнение реакции.
Cu + H 2 SO 4 конц. ® CuSO 4 + SO 2 + H 2 O
Cu + HNO 3 конц. ® Cu(NO 3) 2 + NO 2 + H 2 O
Cu + HNO 3 разб. ® Cu(NO 3) 2 + NO + H 2 O
Опыт 2. Получение и свойства гидроксида меди(II)
Налейте в пробирку 5-6 капель раствора соли меди(II) и добавьте такой же объём щелочи NaOH (2н). Напишите уравнение реакции, отметив цвет осадка. Разделите осадок на три пробирки. В первую пробирку прилейте 1-2 мл раствора H 2 SO 4 (2н), а во вторую - 1-2 мл раствора NaOH (2н). Что наблюдаете? Проявляет ли гидроксид меди в этих условиях кислотные свойства? Напишите уравнения реакций. Третью пробирку с гидроксидом меди(II) нагрейте на водяной бане. Что наблюдаете? Сделайте вывод о термической устойчивости гидроксида меди(II). Напишите уравнение реакции.
CuSO 4 + NaOH ® Cu(OH) 2 + Na 2 SO 4
Cu(OH) 2 + H 2 SO 4 ® CuSO 4 + H 2 O
Cu(OH) 2 + NaOH ¹
Cu(OH) 2 CuO + H 2 O
Опыт 3. Окислительные свойства иона меди(II)
Налейте в пробирку примерно 1 мл раствора сульфата меди(II) и добавьте немного раствора KI. Наблюдайте изменение в окраске раствора и выпадение белого осадка CuI. Добавьте несколько капель крахмала. Почему крахмал окрасился в синий цвет? Напишите уравнение реакции.
CuSO 4 + KI ® CuI + + I 2 K 2 SO 4
Опыт 4. Получение аммиаката меди. Качественная реакция на ион Cu 2+
Налейте в пробирку 2-3 капли раствора сульфата меди(II) и прилейте такое же количество раствора NH 4 OH (2н). Составьте уравнение реакции и отметьте цвет осадка сульфата гидроксомеди(II). По каплям добавляйте в пробирку концентрированный раствор NH 4 OH (25%). Наблюдайте за растворением осадка и изменением окраски раствора вследствие образования ионов 2+ . Составьте уравнение реакции.
CuSO 4 + NH 4 OH ® (CuOH) 2 SO 4 + (NH 4) 2 SO 4
(CuOH) 2 SO 4 + (NH 4) 2 SO 4 + NH 4 OH ® SO 4 + H 2 O
Опыт 1. Взаимодействие меди с кислотами - понятие и виды. Классификация и особенности категории "Опыт 1. Взаимодействие меди с кислотами" 2014, 2015-2016.
Медь представляет собой тяжелый металл красного цвета, обладающий очень высокой тягучестью и ковкостью. Атомная масса меди 63,54; плотность 8,9 г/см2, температура плавления 1083°С. С различными элементами медь легко образует сплавы. В ряду напряжений металлов медь стоит правее водорода, нормальный электродный потенциал близок к потенциалу благородных металлов, поэтому химическая активность меди невелика. В нейтральной воде на поверхности меди образуется защитная пленка, которая приостанавливает дальнейшее окисление. При отсутствии кислорода и других окислителей медь не растворяется при комнатной температуре в серной кислоте при концентрации до 80%, в горячей серной кислоте медь растворяется при концентрации выше 80%. В азотной кислоте медь растворяется. В растворах соляной кислоты без доступа воздуха медь медленно окисляется, в присутствии воздуха медь реагирует с соляной кислотой очень быстро. Наличие в воздухе паров очень летучей СОЛЯНОЙ КИСЛОТЫ вызывает активную коррозию меди. Медь реагирует с растворами аммиака, хлористого аммония. Медь очень устойчива по отношению к щелочам. В растворах, щелочей на ее поверхности образуются пленки гидратированных оксидов меди, плохо растворимых в щелочах и защищающих металл от дальнейшего действия щелочи. Высока стойкость меди в различных органических растворителях. Химические свойства медных сплавов практически такие же, как у меди. Химическая активность основных составляющих продуктов коррозии на меди и медных сплавах следующая: закись меди куприт, красно-коричневого цвета, не растворяется ни в холодной, ни в горячей воде; при продолжительном кипячении медленно переходит в черную окись меди. В щелочах плохо растворяется, реагирует с кислотами. В холодной разбавленной серной кислоте разлагается с образованием металлической меди в виде мелкодисперсных частиц красно-коричневого цвета, в горячих растворах серной кислоты медленно переходит в раствор в виде средних и кислых сернокислых солей. В муравьиной кислоте растворяется плохо. Растворяется в растворах аммиака, углекислого аммония и трилона Б с образованием прочных комплексных соединений. Окись меди нерастворима ни в холодной, ни в горячей воде. Не реагирует с щелочами. Реагирует с кислотами. В растворах аммиака, углекислого аммония и в щелочном растворе сегнетовой соли практически не растворяется. Основная углекислая медь, малахит зеленого цвета, при 200°С разлагается на воду и черную окись меди. В холодной воде нерастворима, в горячей воде при кипячении разлагается с образованием окиси. В щелочах частично растворяется, частично переходит в синий гидрат окиси, быстро разлагающийся на воду и окись меди. В кислотах растворяется с бурным выделением углекислого газа. Легко растворяется в растворах углекислого аммония, аммиака и щелочном растворе сегнетовой соли.
Основная углекислая медь, азурит, синего цвета. Реакции те же, что и у малахита.
Основная сернокислая медь, синего цвета. Не растворяется ни в холодной, ни в горячей воде. Легко растворяется в кислотах, в растворах углекислого аммония и аммиака. В щелочи переходит в нерастворимый синий гидрат окиси, который разлагается с образованием окиси меди. Растворяется в щелочном растворе сегнетовой СОЛИ.
Хлористая медь бесцветная. Гигроскопична, в химическом отношении неустойчива. В холодной воде практически не растворяется. При нагревании медленно гидролизуется, образуя гидрат закиси, который затем разлагается на закись меди и воду. Растворяется в растворах углекислого аммония и аммиака. Хорошо растворяется В СОЛЯНОЙ кислоте и медленно - в муравьиной. В серной кислоте растворяется частично. В горячих растворах щелочей частично растворяется, остаток переходит в окись меди.
Полнотекстовый поиск:
Главная > Курсовая работа >Химия
C водородом, азотом, графитом, кремнием медь не реагирует. При контакте с водородом медь становится хрупкой (так называемая «водородная болезнь» меди) из-за растворения водорода в этом металле.
В присутствии окислителей, прежде всего кислорода, медь может реагировать с соляной кислотой и разбавленной серной кислотой, но водород при этом не выделяется:
2Cu + 4HCl + O 2 = 2CuCl 2 + 2H 2 O
С азотной кислотой различных концентраций медь реагирует довольно активно, при этом образуется нитрат меди (II) и выделяются различные оксиды азота. Например, с 30%-й азотной кислотой реакция меди протекает так:
3Cu + 8HNO 3 = 3Cu(NO 3) 2 + 2NO + 4H 2 O
С концентрированной серной кислотой медь реагирует при сильном нагревании:
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O
Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
2FeCl 3 + Cu = CuCl 2 + 2FeCl 2
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu 2+ легко образуют комплексы с аммиаком, например, состава 2+ . При пропускании через аммиачные растворы солей меди ацетилена С 2 Н 2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC 2 .
Гидроксид меди Cu(OH) 2 характеризуется преобладанием основных свойств. Он реагирует с кислотами с образованием соли и воды, например:
Сu(OH) 2 + 2HNO 3 = Cu(NO 3) 2 + 2H 2 O
Но Сu(OH) 2 реагирует и с концентрированными растворами щелочей, при этом образуются соответствующие купраты, например:
Сu(OH) 2 + 2NaOH = Na 2
Если в медноаммиачный раствор, полученный растворением Сu(OH) 2 или основного сульфата меди в аммиаке, поместить целлюлозу, то наблюдается растворение целлюлозы и образуется раствор медноаммиачного комплекса целлюлозы.
2.2 Основный карбонат меди и его физико-химические свойства
СuCO(OH)- дигидроксид-карбонат димеди
Иногда встречается в виде зелёных, моноклинных, игольчатых, большей частью сросшихся кристаллов, но чаще всего в виде плотной или волокнистой зелёной массы. При слабом нагревании разлагается без плавления. При нагревании свыше 200˚C он чернеет и превращается в черный порошок оксида меди, одновременно выделяются пары воды и углекислый газ. При осаждении из раствора имеет переменный состав (1-2)CuCO∙Cu(OH) (минерал малахит). Не растворяется в холодной воде, разлагается кипящей водой, кислотами; реагирует с цианидом калия, солями аммония. Переводится в среднюю соль действием CO под избыточным давлением.
Химические свойства:
2.3 Синтез малахита
1) Расчёт исходных масс веществ
CuSO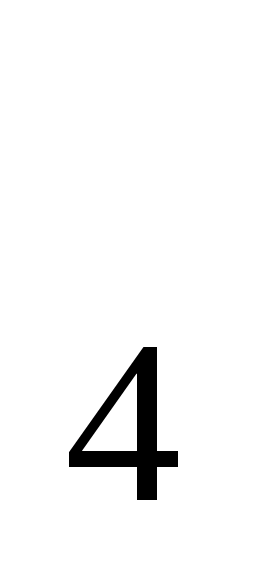 ∙5H 2 O+
4NaHCO=
CuCO∙Cu(OH)↓+
NaSO+
3CO+
11HO
m(CuSO∙5H 2 O)
= 5,5 г
∙5H 2 O+
4NaHCO=
CuCO∙Cu(OH)↓+
NaSO+
3CO+
11HO
m(CuSO∙5H 2 O)
= 5,5 г
2) Описание работы
стеклянная палочка – 2,
воронка Бюхнера – 1,
колба Бунзана – 1,
фильтровальная бумага,
пробирка,
Фарфоровая ступка с пестиком – 1,
термический стакан – 250 мл,
Ход работы.
В фарфоровой ступке смешали 5,5 г. тонко стёртой сухой соли CuSO 4 ·5H 2 O с гидрокарбонатом натрия 3,696 г.
В стакане нагрели до кипения 100 мл. воды. Смесь высыпали небольшими порциями в кипящую воду, быстро перемешивая. При этом наблюдается вспенивание. Следующую порцию смеси вносили после прекращения вспенивания. Содержимое стакана кипятили 10-15 мин для удаления из раствора СО 2 . В результате реакции образуется гидроксокарбонат меди:
2CuSO∙5H 2 O+ 4NaHCO= CuCO∙Cu(OH)↓+ NaSO+ 3CO+ 11HO
Осадку дали отстояться, затем
промывали декантацией горячей водой,
отмывая от иона SO ;
после каждого промывания брали пробу
на полноту промывания: для этого в
пробирку наливали небольшое количество
данного раствора и приливали несколько
капель хлорида бария. Сначала в пробирке
наблюдалось образование белого осадка
(BaSO),
но после семи последовательных декантаций
осадок перестал образовываться.
;
после каждого промывания брали пробу
на полноту промывания: для этого в
пробирку наливали небольшое количество
данного раствора и приливали несколько
капель хлорида бария. Сначала в пробирке
наблюдалось образование белого осадка
(BaSO),
но после семи последовательных декантаций
осадок перестал образовываться.
Оставшийся раствор мы поставили в сушильный шкаф и высушивали в течение пяти дней при температуре 60˚C.
Глава 3. Результаты эксперимента и их обсуждение
3.1 Химические доказательства образования малахита
Для доказательства того, что мы получили именно основный карбонат меди мы провели реакцию разложения и реакцию с HCl.
3.2 Практический выход продукта
Исходя из количества исходных веществ, по данной реакции мы должны были получить основой карбонат меди массой 2,442 г. Но в ходе данного эксперимента мы получили соль массой 2,11 г. Выход продукта составил 84,405%.
3.3 Интересные факты
Мифы, легенды, поверия, фольклор
В качестве камня способного хранить маленьких детей от всяких напастей, с давних времен некоторые используют малахит. А вот по странным уральским поверьям, малахит – «радостный камень»; он приносит удачу и счастье, особенно добрым людям.
Самые известные сказы об уральском малахите, объеденные темой «Малахитовая шкатулка», написал в 1939 году Павел Бажов. Однако сказы и предания о малахите существовали задолго до этого.
Существует одна старая легенда о чудодейственных свойствах малахита. Она гласит, что жили на свете мать и сын. Однажды мать заболела, и лекарь сказал, что спасти ее можно, только приложив к ее груди непрозрачный зеленый камень с красивыми узорами. Камень этот добывали в горах далеко на севере, и сын не успевал съездить за ним, так как матери быстро становилось хуже. Приезжий человек сказал, что в двух днях пути отсюда хан строит новый дворец и там много красивого зеленого камня, которым отделывают парадный вход.
Сын поскакал за камнем. Доскакав до места, он дождался, пока мастера уйдут, и забрал плитку величиной с две ладони, положил за пазуху и направился обратно к своему коню. Это было страшное дело – украсть у хана. Он знал, что если попросить камень для больной матери, то его бросят в тюрьму, поскольку хан своим имуществом ни с кем не делился.
Вдруг стражник заметил вора, который пригнул в седло и поскакал в горы. За ним организовали погоню. Беглец не успевал добраться до пещер и вслух произнес: «Что же делать?» Вдруг он услышал, что ему кто-то отвечает. С ним говорил его конь. «Положи камень мне на спину и упрись в него руками, тогда он сделает нас невидимыми»,- ответил конь. Так они и сделали. Стражники проскакали мимо, не заметив их. Сын привез камень матери. Зеленый камень привязали к груди больной, и хворь стала быстро уходить.
Легенды и предания приписывали малахиту два свойства, которыми не обладали другие минералы. «Первое: малахит мог сделать человека невидимым. Второе: камень помогал понимать язык животных. Для этого надо было выпить из малахитовой чаши или прижать камень к телу так, чтобы его омыл пот.
Малахит связан с созвездием Козерога, и считается, что он добрый талисман, прежде всего для родившихся под этим знаком. Малахит усилит дух Козерога, поднимет настроение и принесет здоровье и успех в дела.
Но он добр не только к ним. Мифы, легенды, сказы и сказания утверждают, что малахит способен помогать всем людям, правда, в определенных ситуациях. Он пробуждает духовные и творческие силы человека, и носить его полезно тем, кто имеет отношение к творчеству, точнее к творческому труду.
Список используемой литературы
Горелов А.А. Экология. – М.: Изд-во Юрайт, 2001. – 128 с.
Здорик Т.Б. Камень, рождающий металл. М.: Изд-во Просвещение, 1984. – 21, 136 с.
Лебединский В.И. В удивительном мире камня. – М.: Кругосвет, 1985. - 198 с.
Путолова Л.С. Самоцветы и цветные камни. – М.: Изд-во Недра, 1991. – 113, 115 - 116 с.
Ферсман А.Е. Рассказы о самоцветах. – М.: изд-во Детгиз, 1952. – 74-76 с.
Корнилов Н.И., Солодова Ю.П. Ювелирные камни. – М.: Изд-во Мир, 1982.- 84,181 с.
Подчайнова В.Н., Симонова Л.Н. Аналитическая химия меди. – М.: Изд-во Наука, 1990. – 7,8-12 с.
Аксёнова М., Храмов Г., Володин В. Камни мира. – М.: Аванта +, 2001 – 76,159 с.
Здорик Т.Б., Матиас В.В., Тимофеев И.Н. Минералы и горные породы СССР. – М.: Изд-во Мысль, 1970. – 136 с.
Лидин Р.А., Молочко В.А., Андреева. Химические свойства неорганических веществ. – М.: Изд-во Химия, 1997. – 289 с.
Викторов С. Ласковый шелк камня // Природа. – 1990. - №4. – 136 с.
Самоцветы // Куликов Б.Ф., Буканов В.В. Словарь камней-самоцветов. – Ленинград: Недра, 1989. – 62 с.
Под ред. Третьякова Ю.Д. Неорганическая химия: в 3 т. – М.: Издательский центр Академия, 2007. – Т.3.
Реми Г. Курс неорганической химии: в 2 т. – М.: Изд-во иностранной литературы, 1963. – Т. 2.
(полимеризационные и поликонденсационные); по отношению к нагреванию (термопластичные и термореактивные); по физико-механическим свойствам ... являются: окраска в массе - получение равномерного цвета (равномерная), поверхностная (краситель...
Детские годы Багрова-внука
Рассказ >> Литература и русский языкИ в ребячестве я страстно предавался. Это свойство называли во мне нелюдимством, дикостью... для переезда в деревню: письмо, полученное от Прасковьи Ивановны Куролесовой. Узнав... лестнице из мрамора зеленого, из малахита медного, с перилами позолоченными, сходит...
Совершенствование системы адаптации персоналом в организации
Реферат >> Государство и правоСтратегию развития предприятия до получения необходимого мастерства управления; Наставничество... оптимизации процедуры наставничества; получение полезной информации, направленной на... того же малахита , мрамора, похожих как качествами и свойствами . Рассмотрим...
И концентрированным кислотам
В три пробирки поместить 2-3 микрошпателя порошка меди и прибавить по 5-6 капель 2 н раствора кислот: в первую соляную, во вторую - серную, в третью - азотную.
Проделать аналогичный опыт с концентрированными кислотами. С какими кислотами взаимодействует медь? Написать уравнение реакции взаимодействия меди с разбавленной азотной кислотой, считая, что при этом образуется оксид азота (II). Как изменяется цвет раствора? Почему медь не взаимодействует с соляной кислотой и с разбавленной серной кислотой? Написать уравнение реакции взаимодействия меди с концентрированными кислотами, считая, что концентрированная азотная кислота восстанавливается медью до оксида азота (IV), а серная до оксида серы (IV).
Опыт 2. Отношение гидроксида меди (II) к кислотам и щелочам
В двух пробирках получить гидроксид меди (II). К полученным осадкам прибавить в одну пробирку 5-6 капель 2 н раствора серной кислоты, в другую столько же 2 н раствора щелочи.
Описать проделанную работу. В каком случае происходит растворение гидроксида меди (II)? Какой вывод можно сделать из этого опыта о свойствах гидроксида меди (II)?
Опыт 3. Получение малорастворимого карбоната гидроксомеди (II)
В пробирку с раствором сульфата меди (II) (2-3 капли) прибавить такое же количество раствора соды. Наблюдать выпадение зеленого осадка карбоната гидроксомеди (II) (CuOH) 2 CO 3 . Почему при взаимодействии с раствором соды не выпадает средний карбонат меди? Написать уравнение взаимодействия сульфата меди с содой при участии воды.
Опыт 4. Получение аммиачного комплекса меди (II)
В пробирку с раствором сульфата меди (II) (2-3 капли) прибавить по каплям 2 н раствор аммиака до полного растворения осадка основной соли (CuOH) 2 SO 4 , выпавшего при добавлении первых капель гидроксида аммония. Отметить окраску исходного раствора сульфата меди (II) и раствора получившегося медноаммиачного комплекса. Какие ионы обуславливают окраску раствора в первом и во втором случае? Написать уравнения реакций:
а) взаимодействия сульфата меди (II) с гидроксидом аммония с образованием осадка сульфата гидроксомеди (II).
б) растворения сульфата гидроксомеди (II) в избытке гидроксида аммония с образованием комплексных соединений.
в) уравнения диссоциации полученных комплексных соединений меди.
Опыт 5. Получение меди химическим восстановлением
Из растворов
Погрузите в раствор нитрата меди (II) предварительно очищенную наждачной бумагой и промытую водой железную пластинку. Через 1-2 мин. выньте пластинку. Напишите уравнение происходящей реакции.
1 В чем сходство и отличие в строении атомов элементов подгруппы меди от щелочных металлов?
2 Чем объяснить появление зеленоватого налета на изделиях из меди при длительном контакте с атмосферным воздухом?
3 Составить уравнения реакций растворения меди и серебра в концентрированной серной кислоте при нагревании?
4 Какое вещество выпадает в осадок при сливании горячих растворов нитрата меди (II) и гидроксида калия? Составить уравнения реакций в молекулярном и молеклярно-ионном видах.
5 Хлорид серебра растворим в растворах аммиака и тиосульфата натрия. Составить уравнения реакций образования комплексных соединений серебра, учитывая, что координационное число иона Аg + равно двум.
АЛЮМИНИЙ
Алюминий - элемент главной подгруппы III группы. На внешнем энергетическом уровне у атома алюминия находится три электрона (s 2 р 1), поэтому в большинстве соединении он проявляет степень окисления (+3)
Алюминий - активный металл. Но при обыкновенной температуре на воздухе не изменяется, так как быстро покрывается тонким плотным слоем оксида, предохраняющим его от дальнейшего окисления. Разрушение этого слоя, например, путем амальгамирования, вызывает быстрое окисление металла. Благодаря наличию защитного слоя алюминий не вытесняет водорода из воды; но лишенный этого слоя, алюминий хорошо реагирует с водой с образованием гидроксида А1(ОН) 3 и водорода.
Алюминий хорошо растворяется в разбавленных кислотах – хлороводородной и серной, особенно при нагревании. Являясь амфотерным металлом, хорошо растворяется в щелочах с образованием гидроксо-алюманатов и водорода:
2Аl+6КОН + 6Н 2 О = 2К 3 [Аl(ОН) 6 ]+ЗН 2 .
Сильно разбавленная и холодная концентрированная азотная кислота, концентрированная серная кислота алюминий не растворяют, так как пассивируют его. Алюминий хорошо реагирует со многими неметаллами: азотом, серой, галогенами.
Алюминий образует оксид Аl 2 О 3 и гидроксид Аl(ОН)з - нерастворимые в воде вещества белого цвета, обладающие амфотерными свойствами.
Соли алюминия, образованные сильными кислотами, вследствие гидролиза имеют в растворах кислую среду. Некоторые соли - сульфиды, карбонатыв водных растворах подвергаются полному гидролизу.
ЛАБОРАТОРНАЯ РАБОТА




