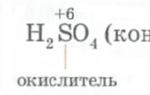С чем взаимодействуют соли примеры. Химические свойства солей и методи их получения
Каждый день мы сталкиваемся с солями и даже не задумываемся, какую роль они играют в нашей жизни. А ведь без них и вода была бы не такой вкусной, и пища не приносила бы удовольствия, и растения не росли, да и жизнь на земле не могла бы существовать, не будь в нашем мире соли. Так что же это за вещества и какие свойства солей делают их незаменимыми?
Что такое соли
По своему составу это самый многочисленный класс, отличающийся разнообразием. Еще в 19 веке химик Й. Верцелиус дал определение соли — это продукт реакции между кислотой и основанием, при которой водородный атом заменяется металлическим. В воде обычно соли диссоциируют на металл или аммоний (катион) и кислотный остаток (анион).
Получить соли можно следующими способами:
- путем взаимодействия металла и неметалла, в этом случае она будет бескислородная;
- при взаимодействии металла с кислотой получается соль и выделяется водород;
- металл может вытеснять другой металл из раствора;
- при взаимодействии двух оксидов — кислотного и основного (еще их называют оксидом неметалла и оксидом металла соответственно);
- при реакции оксида металла и кислоты получаются соль и вода;
- реакция между основанием и оксидом неметалла также дает соль и воду;
- с помощью реакции ионного обмена, при этом могут реагировать разные растворимые в воде вещества (основания, кислоты, соли), но протекать реакция будет, если образуется газ, вода или соли слаборастворимые (нерастворимые) в воде.
Только от химического состава свойства солей и зависят. Но для начала разберемся в их классах.
Классификация
В зависимости от состава выделяют следующие классы солей:
- по содержанию кислорода (кислородсодержащие и бескислородные);
- по взаимодействию с водой (растворимые, малорастворимые и нерастворимые).
Такая классификация отражает все многообразие веществ не полностью. Современная и наиболее полная классификация, отражающая не только состав, но и свойства солей, представлена в следующей таблице.
| Соли | |||||
|---|---|---|---|---|---|
| Нормальные | Кислые | Основные | Двойные | Смешанные | Комплексные |
| Водород полностью замещен | Атомы водорода замещены на металл не полностью | Группы оснований замещены на кислотный остаток не полностью | В составе два металла и один кислотный остаток | В составе один металл и два кислотных остатка | Сложные вещества, состоящие из комплексного катиона и аниона или катиона и комплексного аниона |
| NaCl | KHSO 4 | FeOHSO 3 | KNaSO 4 | CaClBr | SO 4 |
Физические свойства
Как бы ни был широк класс этих веществ, но общие физические свойства солей выделить возможно. Это вещества немолекулярного строения, с ионной кристаллической решеткой.

Очень высокие точки плавления и кипения. При нормальных условиях все соли не проводят электричество, но в растворе большинство из них прекрасно проводит ток.
Цвет может быть самым разным, он зависит от иона металла, входящего в ее состав. Сульфат железа (FeSO 4) — зеленый, хлорид железа (FeCl 3) — темно-красный, а хромат калия (K 2 CrO 4) красивого ярко-желтого цвета. Но большинство солей все-таки бесцветные или белые.

Растворимость в воде также бывает различной и зависит от состава ионов. В принципе, все физические свойства солей имеют особенность. Они зависят от того, ион какого металла и какой кислотный остаток включены в состав. Продолжим рассматривать соли.
Химические свойства солей
Здесь тоже есть важная особенность. Как и физические, химические свойства солей зависят от их состава. А также от того, к какому классу они относятся.

Но общие свойства солей можно все-таки выделить:
- многие из них разлагаются при нагревании с образованием двух оксидов: кислотного и основного, а бескислородные — металла и неметалла;
- взаимодействуют соли и с другими кислотами, но реакция идет, только если в составе соли кислотный остаток слабой или летучей кислоты или в результате получается нерастворимая соль;
- взаимодействие со щелочью возможно, если катион образует нерастворимое основание;
- возможна реакция и между двумя разными солями, но только если одна из вновь образовавшихся солей не растворяется в воде;
- может происходить и реакция с металлом, но она возможна, только если брать металл, расположенный правее в ряду напряжения от металла, содержащегося в соли.
Химические свойства солей, относящихся к нормальным, рассмотрены выше, другие же классы реагируют с веществами несколько иначе. Но отличие идет только по продуктам на выходе. В основном все химические свойства солей сохраняются, как и требования к протеканию реакций.
Данный урок посвящен изучению общих химических свойств еще одного класса неорганических веществ – солей. Вы узнаете с какими веществами могут взаимодействовать соли и каковы условия протекания таких реакций.
Тема: Классы неорганических веществ
Урок: Химические свойства солей
1. Взаимодействие солей с металлами
Соли – сложные вещества, состоящие из атомов металла и кислотных остатков.
Поэтому свойства солей будут связаны с наличием в составе вещества того или иного металла или кислотного остатка. Например, большинство солей меди в растворе имеют голубоватую окраску. Соли марганцовой кислоты (перманганаты) в основном фиолетовые. Знакомство с химическими свойствами солей начнем со следующего опыта.
В первый стакан с раствором сульфата меди (II) опустим железный гвоздь. Во второй стакан с раствором сульфата железа (II) опустим медную пластинку. В третий стакан с раствором нитрата серебра тоже опустим медную пластинку. Через некоторое время мы увидим, что железный гвоздь покрылся слоем меди, медная пластинка из третьего стакана покрылась слоем серебра, а с медной пластинкой из второго стакана ничего не произошло.
Рис. 1. Взаимодействие растворов солей с металлами
Объясним результаты опыта. Реакции произошли только в том случае, если металл, реагирующий с солью, был более активен, чем металл, входящий в состав соли. Сравнить активность металлов между собой можно по их положению в ряду активности. Чем левее расположен металл в этом ряду, тем у него большая способность вытеснить другой металл из раствора соли.
Уравнения проведенных реакций:
Fe + CuSO4 = FeSO4 + Cu
При взаимодействии железа с раствором сульфата меди (II) образуется чистая медь и сульфат железа (II). Эта реакция возможна, т. к. железо имеет большую реакционную способность, чем медь.
Cu + FeSO4 → реакция не идет
Реакция между медью и раствором сульфата железа (II) не протекает, т. к. медь не может заместить железо из раствора соли.
Cu+2AgNO3=2Ag+Cu(NO3)2
При взаимодействии меди с раствором нитрата серебра образуется серебро и нитрат меди (II). Медь замещает серебро из раствора его соли, т. к. медь расположена в ряду активности левее серебра.
Растворы солей могут взаимодействовать с более активными металлами, чем металл в составе соли. Эти реакции относятся к типу замещения.
2. Взаимодействие растворов солей друг с другом
Рассмотрим еще одно свойство солей. Растворенные в воде соли могут взаимодействовать между собой. Проведем опыт.
Смешаем растворы хлорида бария и сульфата натрия. В результате выпадет белый осадок сульфата бария. Очевидно, что прошла реакция.
Уравнение реакции: BaCl2 + Na2SO4 = BaSO4 + 2NaCl
Растворенные в воде соли могут вступать в реакцию обмена, если в результате образуется нерастворимая в воде соль.
3. Взаимодействие солей со щелочами
Выясним, взаимодействуют ли соли с щелочами, проведя следующий опыт.
В раствор сульфата меди (II) прильем раствор гидроксида натрия. В результате выпадает синий осадок.

Рис. 2. Взаимодействие раствора сульфата меди(II) со щелочью
Уравнение проведенной реакции: CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Данная реакция является реакцией обмена.
Соли могут взаимодействовать со щелочами, если в результате реакции образуется нерастворимое в воде вещество.
4. Взаимодействие солей с кислотами
В раствор карбоната натрия прильем раствор соляной кислоты. В результате мы видим выделение пузырьков газа. Объясним результаты опыта, записав уравнение данной реакции:
Na2CO3 + 2HCl= 2NaCl + H2CO3
H2CO3 = H2O + CO2
Угольная кислота - вещество нестойкое. Она разлагается на углекислый газ и воду. Данная реакция является реакцией обмена.
Соли могут вступать в реакцию обмена с кислотами, если в результате реакции выделяется газ или образуется осадок.
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П. А. Оржековского и др. «Химия. 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.107-111)
2. Ушакова О. В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006. (с.108-110)
3. Химия. 8 класс. Учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.:Астрель, 2013. (§34)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005. (§40)
5. Химия: неорг. химия: учеб. для 8 кл. общеобразоват. учреждений / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§33)
6. Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Взаимодействия кислот с солями.
2. Взаимодействия металлов с солями.
Домашнее задание
1) с. 109-110 №№ 4,5 из Рабочей тетради по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006.
2) с.193 №№ 2,3 из учебника П. А. Оржековского, Л. М. Мещеряковой, М. М. Шалашовой «Химия: 8кл.», 2013 г.
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO 4 – сульфат кальция и т. д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na + Cl – – хлорид натрия
Ca 2+ SO 4 2– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na 2 CO 3 , KNO 3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO 3 , NaH 2 PO 4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO 3 , KAl(SO 4) 2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO 4 , Zn(OH)Cl и т.д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO 4 – сульфат кальция, Mg SO 4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI 2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl 3) 2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH 2 PO 4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
 Химические свойства солей
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO 3 = CaO + CO 2
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H 2 SO 4 → Na 2 SO 4 + 2HCl.
3. Взаимодействуют с основаниями , образуя новую соль и новое основание:
Ba(OH) 2 + Mg SO 4 → BaSO 4 ↓ + Mg(OH) 2 .
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO 3 → AgCl + NaNO 3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO 4 → FeSO 4 + Cu↓.
Остались вопросы? Хотите знать больше о солях?
Чтобы получить помощь репетитора – .
Первый урок – бесплатно!
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Основания
Основаниями называются соединения, содержащие в качестве аниона только гидроксид ионов ОН - . Число гидроксид ионов, способных замещаться кислотным остатком, определяет кислотность основания. В связи с этим основания бывают одно-, двух- и поликислотные однако к истинным основаниям чаще всего относят одно- и двухкислотные. Среди них следует выделить растворимые и не растворимые в воде основания. Учтите, что растворимые в воде и диссоциирующие при этом практически нацело основания называют щелочами (сильные электролиты). К ним относятся гидроксиды щелочных и щелочноземельных элементов и ни в коем случае раствор аммиака в воде.
Название основания начинается со слова гидроксид, после которого в родительном падеже приводится русское название катиона, а в круглых скобках указывается его заряд. Допускается перечисление количества гидроксид ионов с помощью приставок ди-, три-, тетра. Например: Mn(OH) 3 - гидроксид марганца (III) или тригидроксид марганца.
Обратите внимание на то, что между основаниями и основными оксидами существует генетическая связь: основным оксидам соответствуют основания. Поэтому катионы оснований чаще всего имеют заряд один или два, что соответствует низшим степеням окисления металлов.
Запомните основные способы получения оснований
1. Взаимодейетвие активных металлов с водой:
2Na + 2Н 2 О = 2NаОН + Н 2
Lа + 6Н 2 О = 2Lа(ОН) 3 + 3H 2
Взаимодействие основных оксидов с водой:
СаО + Н 2 О = Са(ОН) 2
МgО + Н 2 О = Мg(ОН) 2 .
3. Взаимодействие солей со щелочами:
МnSO 4 + 2КОН = Mn(OH) 2 ↓ + K 2 SО 4
NH 4 С1 + NaOH = NaCl + NH 3 ∙ H 2 O
Nа 2 СO 3 + Са(ОН) 2 = 2NаОН + CaCO 3
MgOHCl + NaOH = Mg(OH) 2 + NaCl.
Электролиз водных растворов солей с диафрагмой:
2NaCl + 2H 2 O → 2NaOH + Cl 2 + Н 2
Учтите, что в пункте 3 исходные реагенты необходимо подбирать таким образом, чтобы среди продуктов реакции было либо труднорастворимое соединение, либо слабый электролит.
Обратите внимание на то, что при рассмотрении химических свойств оснований условия проведения реакций зависят от растворимости основания.
1. Взаимодействие с кислотами:
NaOH + Н 2 SO 4 = NaHSO 4 + Н 2 O
2NaOH + Н 2 SO 4 = Na 2 SO 4 + 2Н 2 O
2Mg(OH) 2 + H 2 SO 4 = (MgOH) 2 SO 4 + 2H 2 O
Mg(OH) 2 + H 2 SO 4 = MgSO 4 + 2H 2 O
Mg(OH) 2 + 2H 2 SO 4 = Mg(HSO 4) 2 + 2H 2 O
2. Взаимодействие с кислотными оксидами:
NaOH + CO 2 = NaHCO 3
2NaOH + CO 2 = Na 2 CO 3 + H 2 O
Fe(OH) 2 + P 2 O 5 = Fe(PO 3) 2 + H 2 O
ЗFе(OH) 2 + P 2 O 5 = Fe 3 (PO 4) 2 + 2H 2 O
3. Взаимодействие с амфотерными оксидами:
А1 2 O 3 + 2NaOH p +3H 2 O = 2Na
Al 2 O 3 + 2NaOH T = 2NaAlO 2 + H 2 O
Cr 2 O 3 + Mg(OH) 2 = Mg(CrO 2) 2 + H 2 O
4. Взаимодействие с амфтерными гидроксидами:
Са(ОН) 2 + 2Al(ОН) 3 = Ca(AlO 2) 2 + 4H 2 O
3NaOH + Cr(ОН) 3 = Na 3
Взаимодействие с солями.
К реакциям, описанным в пункте 3 способов получения, следует добавить:
2ZnSO 4 + 2КОН = (ZnOH) 2 S0 4 + K 2 SO 4
NaHCO 3 + NaOH = Na 2 CO 3 + Н 2 O
BeSO 4 + 4NaOH = Na 2 + Na 2 SO 4
Cu(OH) 2 + 4NH 3 ∙H 2 O = (OH) 2 + 4H 2 O
6. Окисление до амфотерных гидроксидов или солей:
4Fe(ОН) 2 + O 2 + 2Н 2 O = 4Fe(OH) 3
2Сг(ОН) 2 + 2Н 2 O + Na 2 O 2 + 4NaOH = 2Na 3 .
7. Разложение при нагревании:
Са(OН) 2 = СаО + Н 2 О.
Учтите, что гидроксиды щелочных металлов, кроме лития, в таких реакциях не участвуют.
!!!Бывают ли щелочные осадки?!!! Да, бывают, однако они не столь распространены, как кислотные осадки, малоизвестны, а их влияние на объекты окружающей среды практически не исследовано. Тем не менее их рассмотрение заслуживает внимания.
Происхождение щелочных осадков можно объяснить следующим образом.
СаСО 3 →СаО + СO 2
В атмосфере оксид кальция соединяется с водяными парами при их конденсации, с дождем или мокрым снегом, образуя при этом гидроксид кальция:
CaO + H 2 O →Ca(OH) 2 ,
который и создает щелочную реакцию атмосферных осадков. В дальнейшем возможно взаимодействие гидроксида кальция с углекислым газом и водой с образованием карбоната и гидрокарбоната кальция:
Са(ОН) 2 + СO 2 → СаСO 3 + Н 2 О;
СаСО 3 + СO 2 + H 2 O → Са(НС0 3) 2 .
Химический анализ дождевой воды показал, что в ней в незначительном количестве присутствуют сульфат- и нитрат-ионы (порядка 0,2 мг/л). Как известно, причиной кислотного характера осадков являются серная и азотная кислоты. В то же время наблюдается большое содержание катионов кальция (5-8 мг/л) и гидрокарбонат-ионов, содержание которых в районе предприятий строительного комплекса в 1,5-2 раза больше, чем в других районах города, и составляет 18-24 мг/л. Это показывает, что в образовании локальных щелочных осадков главную роль играет карбонатно-кальциевая система и происходящие в ней процессы, о чем было сказано выше.
Щелочные осадки оказывают влияние на растения, отмечаются изменения в фенотипическом строении растений. Наблюдаются следы «ожогов» на листовых пластинках, белый налет на листьях и угнетенное состояние травянистых растений.
1. Соли являются электролитами.
В водных растворах соли диссоциируют на положительно заряженные ионы (катионы) металлов и отрицательно заряженные ионы (анионы) кислотных остатков.
Например , при растворении кристаллов хлорида натрия в воде положительно заряженные ионы натрия и отрицательно заряженные ионы хлора, из которых образована кристаллическая решётка этого вещества, переходят в раствор:
NaCl → Na + + Cl − .
При электролитической диссоциации сульфата алюминия образуются положительно заряженные ионы алюминия и отрицательно заряженные сульфат-ионы:
Al 2 SO 4 3 → 2 Al 3 + + 3 SO 4 2 − .
2. Соли могут взаимодействовать с металлами.
В ходе реакции замещения, протекающей в водном растворе, химически более активный металл вытесняет менее активный.
Например , если кусочек железа поместить в раствор сульфата меди, он покрывается красно-бурым осадком меди. Раствор постепенно меняет цвет с синего на бледно-зелёный, поскольку образуется соль железа(\(II\)):
Fe + Cu SO 4 → Fe SO 4 + Cu ↓ .
Видеофрагмент:
При взаимодействии хлорида меди(\(II\)) с алюминием образуются хлорид алюминия и медь:
2 Al + 3Cu Cl 2 → 2Al Cl 3 + 3 Cu ↓ .
3. Соли могут взаимодействовать с кислотами.
Протекает реакция обмена, в ходе которой химически более активная кислота вытесняет менее активную.
Например
, при взаимодействии раствора хлорида бария с серной кислотой образуется осадок сульфата бария, а в растворе остаётся соляная кислота:
BaCl 2 + H 2 SO 4 → Ba SO 4 ↓ + 2 HCl .
При взаимодействии карбоната кальция с соляной кислотой образуются хлорид кальция и угольная кислота, которая тут же разлагается на углекислый газ и воду:
Ca CO 3 + 2 HCl → CaCl 2 + H 2 O + CO 2 ⏟ H 2 CO 3 .
Видеофрагмент:
4. Растворимые в воде соли могут взаимодействовать со щелочами.
Реакция обмена возможна в том случае, если в результате хотя бы один из продуктов является практически нерастворимым (выпадает в осадок).
Например
, при взаимодействии нитрата никеля(\(II\)) с гидроксидом натрия образуются нитрат натрия и практически нерастворимый гидроксид никеля(\(II\)):
Ni NO 3 2 + 2 NaOH → Ni OH 2 ↓ + 2Na NO 3 .
Видеофрагмент:
При взаимодействии карбоната натрия (соды) с гидроксидом кальция (гашёной известью) образуются гидроксид натрия и практически нерастворимый карбонат кальция:
Na 2 CO 3 + Ca OH 2 → 2NaOH + Ca CO 3 ↓ .
5. Растворимые в воде соли могут вступать в реакцию обмена с другими растворимыми в воде солями, если в результате образуется хотя бы одно практически нерастворимое вещество.
Например
, при взаимодействии сульфида натрия с нитратом серебра образуются нитрат натрия и практически нерастворимый сульфид серебра:
Na 2 S + 2Ag NO 3 → Na NO 3 + Ag 2 S ↓ .
Видеофрагмент:
При взаимодействии нитрата бария с сульфатом калия образуются нитрат калия и практически нерастворимый сульфат бария:
Ba NO 3 2 + K 2 SO 4 → 2 KNO 3 + BaSO 4 ↓ .
6. Некоторые соли при нагревании разлагаются.
Причём химические реакции, которые протекают при этом, можно условно разделить на две группы:
- реакции, в ходе которых элементы не изменяют степень окисления,
- окислительно-восстановительные реакции.
A. Реакции разложения солей, протекающие без изменения степени окисления элементов.
В качестве примеров таких химических реакций рассмотрим, как протекает разложение карбонатов.
При сильном нагревании карбонат кальция (мел, известняк, мрамор) разлагается, образуя оксид кальция (жжёную известь) и углекислый газ:
CaCO 3 ⇄ t ° CaO + CO 2 .
Видеофрагмент:
Гидрокарбонат натрия (пищевая сода) при небольшом нагревании разлагается на карбонат натрия (соду), воду и углекислый газ:
2 NaHCO 3 ⇄ t ° Na 2 CO 3 + H 2 O + CO 2 .
Видеофрагмент:
Кристаллогидраты солей при нагревании теряют воду. Например, пентагидрат сульфата меди(\(II\)) (медный купорос), постепенно теряя воду, превращается в безводный сульфат меди(\(II\)):
CuSO 4 ⋅ 5 H 2 O → t ° Cu SO 4 + 5 H 2 O .
При обычных условиях образовавшийся безводный сульфат меди можно превратить в кристаллогидрат:
CuSO 4 + 5 H 2 O → Cu SO 4 ⋅ 5 H 2 O
Видеофрагмент:
Разрушение и образование медного купороса
|