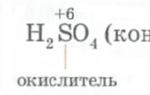Характеристика магния. Магний
Магний - (лат. Magnesium), Mg (читается «магний»), химический элемент IIА группы третьего периода периодической системы Менделеева, атомный номер 12, атомная масса 24,305. Природный магний состоит из трех стабильных нуклидов: 24 Mg (78,60% по массе), 25 Mg (10,11%) и 26 Mg (11,29%). Электронная конфигурация нейтрального атома 1s 2 2s 2 2p 6 3s 2 , согласно которой магний в стабильных соединениях двухвалентен (степень окисления +2). Магний относится к щелочноземельным металлам.
История открытия магния
Соединения магния были известны человеку с давних пор. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
В XVII в. начался новый период в истории химической науки. Именно в этот период произошло открытие, в значительной степени предвосхитившее открытие элемента магния. В 1695 г. Н. Гро, выпаривая минеральную воду Эпсомского источника (Англия), получил соль, обладавшую горьким вкусом и слабительным действием. Спустя несколько лет выяснилось, что при взаимодействии с «постоянной щелочью» (так в те времена называли соду и поташ) эта соль образует белый рыхлый порошок. Точно такой же порошок получался при прокаливании минерала, найденного в окрестностях греческого города Магнезии. За это сходство эпсомская соль получила название белой магнезии.
В 1808 г. Хэмфри Дэви при электролизе слегка увлажненной белой магнезии с окисью ртути получил амальгаму нового металла, который вскоре был из нее выделен и назван магнием. Правда, магний, полученный Дэви, был загрязнен примесями; первый действительно чистый магний получен А. Бюсси в 1829 г.
Нахождение в природе магнияЗемная кора богата магнием – в ней содержится более 2,1% этого элемента. Лишь шесть элементов периодической системы встречаются на Земле чаще магния. Он входит в состав почти двухсот минералов. Но получают его в основном из трех – магнезита, доломита и карналлита.
Большие количества магния находятся в морской воде. Главными видами нахождения магнезиального сырья являются:
- морская вода - (Mg 0,12-0,13 %),
- карналлит - MgCl 2 KCl 6H 2 O (Mg 8,7 %),
- бишофит - MgCl 2 6H 2 O (Mg 11,9 %),
- кизерит - MgSO 4 H 2 O (Mg 17,6 %),
- эпсомит - MgSO 4 7H 2 O (Mg 16,3 %),
- каинит - KCl MgSO 4 3H 2 O (Mg 9,8 %),
- магнезит - MgCO 3 (Mg 28,7 %),
- доломит - CaCO 3 ·MgCO 3 (Mg 13,1 %),
- брусит - Mg(OH) 2 (Mg 41,6 %).
Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения ископаемых солей карналлита осадочного происхождения известны во многих странах.
Магнезит образуется преимущественно в гидротермальных условиях и относится к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны. Они ассоциируют с карбонатными толщами и большинство из них имеет докембрийский или пермский возраст. Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод.
Магний находится в следующих видах месторождений:- Ископаемые минеральные отложения (магнезиальные и калийно-магнезиальные соли)
- Морская вода
- Рассолы (рапа соляных озёр)
- Природные карбонаты (доломит и магнезит)
Получают металл двумя способами – электротермическим (или металлотермическим) и электролитическим. Как явствует из названий, в обоих процессах участвует электричество. Но в первом случае его роль сводится к обогреву реакционных аппаратов, а восстанавливают окись магния, полученную из минералов, каким-либо восстановителем, например углем, кремнием, алюминием. Этот способ довольно перспективен, в последнее время он находит все большее применение. Однако основной промышленный способ получения магния – второй, электролитический.
Электролитом служит расплав безводных хлоридов Mg, калия и натрия; металлический магний выделяется на железном катоде, а на графитовом аноде разряжаются ионы хлора. Процесс идет в специальных ваннах-электролизерах. Расплавленный магний всплывает на поверхность ванны, откуда его время от времени выбирают вакуум-ковшом и затем разливают по формам.
Но на этом процесс не заканчивается: в таком магнии еще слишком много примесей.
Поэтому неизбежен второй этап – очистка магния. Рафинировать магний можно двумя путями – переплавкой и флюсами или возгонкой в вакууме. Смысл первого метода общеизвестен: специальные добавки – флюсы – взаимодействуют с примесями и превращают их в соединения, которые легко отделить от металла механическим путем. Второй метод – вакуумная возгонка – требует более сложной аппаратуры, но с его помощью получают более чистый магний. Возгонку ведут в специальных вакуум-аппаратах – стальных цилиндрических ретортах. «Черновой» металл помещают на дно реторты, закрывают ее и выкачивают воздух. Затем нижнюю часть реторты нагревают, а верхняя все время охлаждается наружным воздухом. Под действием высокой температуры магний возгоняется – переходит в газообразное состояние, минуя жидкое. Пары его поднимаются и конденсируются на холодных стенках верхней части реторты.
Таким путем можно получать очень чистый металл, содержащий свыше 99,99% магния.
Физические свойства магнияМеталл в 5 раз легче меди, в 4,5 раза легче железа; даже алюминий в 1,5 раза тяжелее магния.
Магний - металл серебристо-белого цвета с гексагональной решёткой (a=3,21 Å c=5,21 Å). При обычных условиях поверхность магния покрыта прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg 3 N 2 .
Плотность магния при 20 °C - 1,74 г/см³, температура плавления металла t пл = 650 °C, температура кипения - t кип = 1105 °C, теплопроводность при 20 °C - 156 Вт/(м К). Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
При горении магния выделяется большое количество ультрафиолетовых лучей и тепла – чтобы нагреть стакан ледяной воды до кипения, нужно сжечь всего 4 г магния.
Магний взрыво- и пожароопасен
Работа со сплавами магния иногда причиняет немало хлопот – магний легко окисляется. Плавку и литье этих сплавов приходится вести под слоем шлака – иначе расплавленный металл может загореться от соприкосновения с воздухом.
При шлифовке или полировке магниевых изделий над станком обязательно устанавливается раструб пылеотсасывающего устройства, потому что распыленные в воздухе мельчайшие частицы магния создают взрывоопасную смесь.
Однако это не значит, что всякая работа с магнием чревата опасностью пожара или взрыва. Поджечь магний можно, только расплавив его, а сделать это в обычных условиях не так-то просто – большая теплопроводность сплава не позволит спичке или даже факелу превратить литые изделия в белый порошок окиси. А вот со стружкой или тонкой лентой из магния нужно действительно обращаться очень осторожно.
Химические свойства магнияХимические свойства магния довольно своеобразны. Он легко отнимает кислород и хлор у большинства элементов, не боится едких щелочей, соды, керосина, бензина и минеральных масел. В то же время он совершенно не выносит действия морской и минеральной воды и довольно быстро растворяется в них. Почти не реагируя с холодной пресной водой, он энергично вытесняет водород из горячей.
Смесь порошкового магния с перманганатом калия KMnO 4 - взрывчатое вещество
Раскаленный магний реагирует с водой:
Mg (раск.) + Н 2 О = MgO + H 2 ;
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением
водорода:
Mg + 2HCl = MgCl 2 + H 2 ;
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом
может образовываться небольшое количество нитрида:
2Mg + О 2 = 2MgO;
3Mg + N 2 = Mg 3 N 2
Так как оксид магния MgO при взаимодействии с водой щелочей не образует, а основание магния Mg(OH) 2 щелочными свойствами не обладает, магний, в отличие от своих «согруппников» - кальция, стронция и бария, не относится к числу щелочноземельных металлов.
Металлический магний при комнатной температуре реагирует с галогенами, например, с бромом:
Mg + Br 2 = MgBr 2 .
При нагревании магний вступает во взаимодействие с серой, давая сульфид магния:
Если в инертной атмосфере прокаливать смесь магния и кокса, то образуется карбид магния состава Mg 2 C 3 (следует отметить, что ближайший сосед магния по группе - кальций - в аналогичных условиях образует карбид состава СаС2). При разложении карбида магния водой образуется гомолог ацетилена - пропин С 3 Н 4:
Mg 2 C 3 + 4Н 2 О = 2Mg(OH) 2 + С 3 Н 4 .
Поэтому Mg 2 C 3 можно назвать пропиленидом магния.
В поведении магния есть черты сходства с поведением щелочного металла лития (пример диагонального сходства элементов в таблице Менделеева). Так, магний, как и литий, реагирует с азотом (реакция магния с азотом протекает при нагревании), в результате образуется нитрид магния:
3Mg + N 2 = Mg 3 N 2 .
Как и нитрид лития, нитрид магния легко разлагается водой:
Mg 3 N 2 + 6Н 2 О = 3Mg(ОН) 2 + 2NН 3 .
Сходство с литием проявляется у магния и в том, что его карбонат MgCO 3 и фосфат Mg 3 (PO 4) 2 в воде плохо растворимы, как и соответствующие соли лития.
С кальцием магний сближает то, что присутствие в воде растворимых гидрокарбонатов этих элементов обусловливает жесткость воды. Как и в случае гидрокарбоната кальция, жесткость, вызванная гидрокарбонатом магния Mg(HCO3) 2 , - временная. При кипячении гидрокарбонат магния Mg(HCO 3) 2 разлагается и в осадок выпадает его основной карбонат - гидроксокарбонат магния (MgOH) 2 CO 3:
2Mg(HCO 3) 2 = (MgOH) 2 CO 3 + 3CO 2 + Н 2 О.
Перхлорат магния Mg(ClO 4) 2 , энергично взаимодействующий с парами воды, хорошо осушающий воздух или другой газ, проходящий через его слой. При этом образуется прочный кристаллогидрат Mg(ClO 4) 2 ·6Н 2 О. Это вещество можно вновь обезводить, нагревая в вакууме при температуре около 300°C. За свойства осушителя перхлорат магния получил название «ангидрон».
Влияние магния на организм человекаМагний - один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений. Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатина фосфата в АТФ - нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Поэтому магний является тем элементом, который контролирует энергетику организма. Магний необходим на всех этапах синтеза белка. Установлено также, что 80-90 % современных людей страдают от дефицита магния. Это может проявляться по-разному: бессонница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС) и прочие симптомы и болезни. А при частом употреблении слабительных, алкоголя, больших психических и физических нагрузках потребность в магнии увеличивается.
Статистика утверждает, что у жителей районов с более теплым климатом спазмы кровеносных сосудов случаются реже, чем у северян. Медицина объясняет это особенностями питания тех и других. Ведь известно, что внутривенные и внутримышечные вливания растворов некоторых солей магния снимают спазмы и судороги. Накопить в организме необходимый запас этих солей помогают фрукты и овощи. Особенно богаты магнием абрикосы, персики и цветная капуста. Есть он и в обычной капусте, картофеле, помидорах.
По результатам последних исследований обнаружено, что цитрат магния является наиболее усваиваемым магниесодержащим продуктом.
Чтобы усвоить кальций, организму необходим магний. Одним из наиболее биологически целесообразных источников магния при транскутанном (чрезкожном) всасывании является минерал бишофит, широко использующийся в целях медицинской реабилитации, физиотерапии и санаторно-курортного лечения.
Несколько лет назад ученые Миннесотского университета в США избрали объектом научного исследования яичную скорлупу. Им удалось установить, что скорлупа тем прочнее, чем больше она содержит магния. Значит, изменяя состав корма для несушек, можно повысить прочность скорлупы.
Французские биологи считают, что магний поможет медикам в борьбе с таким серьезным недугом XX в., как переутомление. Исследования показывают, что в крови уставших людей содержится меньше магния, чем у здоровых, а даже самые ничтожные отклонения «магниевой крови» от нормы не проходят бесследно.
Важно помнить, что в тех случаях, когда человек часто и по любому поводу раздражается, магний, содержащийся в организме, «сгорает». Вот почему у нервных, легко возбудимых людей нарушения работы сердечных мышц наблюдаются значительно чаще.
Магний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета.
1 элемент таблицы Менделеева В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO4 · 7H2O. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
В 1792 году Антон фон Рупрехт получил новый металл, названный им австрием, восстановлением углём из белой магнезии. Позже было установлено, что «австрий» представляет собой магний крайне низкой степени чистоты, поскольку исходное вещество было сильно загрязнёно железом.
История открытия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO4 · 7H2O. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
В 1792 году Антон фон Рупрехт получил новый металл, названный им австрием, восстановлением углём из белой магнезии. Позже было установлено, что «австрий» представляет собой магний крайне низкой степени чистоты, поскольку исходное вещество было сильно загрязнено железом.
Впервые был выделен в чистом виде сэром Гемфри Дэви в 1808 году дистилляцией ртути из магниевой амальгамы, которую он получил электролизом полужидкой смеси оксида магния и ртути.
Нахождение в природе
Кларк магния (масс.) — 1,95 % (19,5 кг/т). Это один из самых распространённых элементов земной коры. Большие количества магния находятся в морской воде. Главными видами нахождения магнезиального сырья являются:
морская вода — (Mg 0,12—0,13 %),
карналлит — MgCl2 . KCl . 6H2O (Mg 8,7 %),
бишофит — MgCl2 . 6H2O (Mg 11,9 %),
кизерит — MgSO4 . H2O (Mg 17,6 %),
эпсомит — MgSO4 . 7H2O (Mg 16,3 %),
каинит — KCl . MgSO4 . 3H2O (Mg 9,8 %),
магнезит — MgCO3 (Mg 28,7 %),
доломит — CaCO3·MgCO3 (Mg 13,1 %),
брусит — Mg(OH)2 (Mg 41,6 %).
Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения ископаемых солей карналлита осадочного происхождения известны во многих странах.
Магнезит образуется преимущественно в гидротермальных условиях и относится к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны. Они ассоциируют с карбонатными толщами, и большинство из них имеет докембрийский или пермский возраст. Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод.
ТАБЛИЦА НОРМЫ ПОТРЕБЛЕНИЯ МАГНИЯ
| Пол | Возраст | Суточная норма потребления магния, мг/день | Верхний допустимы предел, мг/день |
|---|---|---|---|
| Младенцы | от 0 до 6 месяцев | 30 | Не определен |
| Младенцы | от 7 до 12 месяцев | 75 | Не определен |
| Дети | от 1 до 3 лет | 80 | 145 |
| Дети | от 4 до 8 лет | 130 | 240 |
| Дети | от 9 до 13 лет | 240 | 590 |
| Девушки | от 14 до 18 лет | 360 | 710 |
| Юноши | от 14 до 18 лет | 410 | 760 |
| Мужчины | от 19 до 30 лет | 400 | 750 |
| Мужчины | 31 год и старше | 420 | 770 |
| Женщины | от 19 до 30 лет | 310 | 660 |
| Женщины | 31 год и старше | 320 | 670 |
| Беременные женщины | от 14 до 18 лет | 400 | 750 |
| Беременные женщины | от 19 до 30 лет | 350 | 700 |
| Беременные женщины | 31 год и старше | 360 | 710 |
| Кормящие грудью женщины | от 14 до 18 лет | 360 | 710 |
| Кормящие грудью женщины | от 19 до 30 лет | 310 | 660 |
| Кормящие грудью женщины | 31 год и старше | 320 | 670 |
Ковкий, серебристо белый металл

Магний / Magnesium (Mg), 12
(молярная масса)
[комм 1] а. е. м. (г/моль)
1,31 (шкала Полинга)
(первый электрон)
737,3 (7,64) кДж/моль (эВ)
1,738 г/см³
650 °C (923 K)
1090 °C (1363 K)
9,20 кДж/моль
131,8 кДж/моль
24,90 Дж/(K·моль)
14,0 см³/моль
гексагональная
a =0,32029 нм, c =0,52000 нм
Магний – это жизненно важный микроэлемент, щелочноземельный металл, без которого не обходятся основные этапы метаболизма. Обозначается символом Mg , латинское название Magnesium. Элемент открыт в 1755 году.
Метаболизм (или обмен веществ) является основой жизнедеятельности любого живого организма, представляет собой каскад химических реакций, которые обеспечивают организм необходимыми веществами, а также достаточным количеством энергии. В метаболизме участвуют витамины, микроэлементы, ферменты и множество других соединений. Магний участвует во многих биохимических реакциях и является одним из важнейших компонентов в регуляции большинства физиологических процессов. Без магния невозможна активация не менее трехсот ферментов, а также витаминов группы В. Магний принимает участие во всех видах обмена: углеводном, липидном и белковом. Этот микроэлемент необходим для поддержания электролитного баланса.
Особая роль принадлежит магнию в функционировании нервной и мышечной тканей, которые обладают спонтанной электрической активностью и проводимостью: магний в данном случае регулирует проницаемость клеточных мембран для других ионов и адекватную работу калий/натриевого насоса в них. Не последнюю роль играет магний в иммунологических процессах организма.
Магний участвует в терморегуляции организма, обмене кальция, натрия, аскорбиновой кислоты, фосфора, в синтезе фосфолипидов, оказывает сосудорасширяющее действие и препятствует агрегации эритроцитов. В организме магний активен в виде ионов Mg двухвалентного, так как только в такой форме он может образовывать соединения с органическими веществами и выполнять свои функции в биохимических процессах.
Потребность в магнии
Суточная потребность организма в магнии в среднем составляет около 400 мг . Для беременных женщин эта цифра возрастает до 450 мг .Детям необходимо ежесуточное поступление 200 мг микроэлемента.
У спортсменов и людей, подвергающихся высокой физической нагрузке, потребность в магнии значительно возрастает – до 600 мг/сут , особенно во время длительных тренировок, в стрессовых ситуациях.
В организме микроэлемент распределяется в тканях органов и систем, при этом наибольшая концентрация его наблюдается в печени, в костях, в мышцах и в тканях центральной и периферической нервной системы. Попадает в организм с пищей, водой и солью. Выводится в основном кишечником и, в меньшей степени, почками.
Для определения содержания ионов магния в организме проводится анализ крови , взятой из локтевой вены с утра натощак, перед сдачей анализа необходимо воздержаться от приема солей магния не менее чем на трое суток. В норме этот показатель составляет: у взрослых от 0,66 ммоль/л до 1,07 ммоль/л (для категории 20-60 лет) и от 0,66 ммоль/л до 0,99 моль/л (для категории 60-90 лет), у детей от 0,70 ммоль/л до 0,95 ммоль/л (возраст 5 мес.-6 лет) и от 0,70 моль/л до 0,86 ммоль/л (6-9 лет).
Причиной повышения концентрации магния в плазме крови может послужить почечная недостаточность, надпочечниковая недостаточность и обезвоживание различного происхождения. Снижение концентрации наблюдается при остром панкреатите, недостаточном поступлении магния с пищей, во 2 и 3 триместре беременности, при дефиците витамина Д, а также при усиленной функции паращитовидных желез, алкоголизме.
Для поддержания нормального уровня магния в плазме крови организм берет его из так называемых «депо» - органов и тканей. Поэтому указанные показатели долгое время могут оставаться на должном уровне, то есть в пределах нормы, даже если в организм поступает недостаточное количество магния. Изменение нормальных показателей в плазме крови говорит о далеко зашедшем процессе.
Дефицит магния
О дефиците магния в организме могут сигнализировать ряд симптомов, выраженных в большей или меньшей степени. Нередко, несмотря на плохое самочувствие, люди не обращают внимания на их появление, списывая все на большую загруженность на работе и усталость. Нарушение сна, повышенная утомляемость, так называемый «синдром хронической усталости», снижение памяти, головокружение, головная боль, депрессия и плаксивость – все это может быть следствием недостаточного количества магния.Со стороны сердечно-сосудистой системы это: аритмия , боль в грудной клетке . Со стороны ЖКТ: спастические боли в области желудка, поносы. Появляются «необъяснимые» боли в различных областях тела: деснах, конечностях, суставах. Судороги в икроножных мышцах, различные тики, тремор конечностей. Наблюдается повышенная ломкость ногтей и волос, сухость кожи, кариес. Длительно существующий дефицит магния значительно повышает риск развития сахарного диабета.
Женщины переносят дефицит магния хуже, чем мужчины. Это связано с различной физиологией мужчин и женщин. Женщинам магний необходим для нормальной менструальной и репродуктивной функции. В зависимости от фазы менструального цикла в женском организме колеблется концентрация магния. Достоверно известно, что симптомы предменструального синдрома (ПМС), а именно: раздражительность, увеличение веса, отечность, зябкость и другие многочисленные явления, связаны именно с дефицитом магния.
Избыток микроэлемента магния не менее вреден для здоровья. В большой концентрации магний тормозит усвоение организмом кальция (магний замещает его). При концентрации его в плазме крови 15-18 мг% вызывает наркоз. Признаки избытка магния в организме: общее угнетение нервной системы, сонливость и вялость. Также может возникнуть остеопороз, снижение артериального давления, брадикардия (урежение сердечных сокращений).
Передозировка
Передозировка магния может наблюдаться при неправильном дозировании препаратов магния, в основном при внутривенном введении. Не стоит опасаться избыточного поступления в организм с пищей , так как в повседневном рационе присутствуют в основном рафинированные продукты, бедные магнием. Часть микроэлемента теряется при термической обработке и при консервации. Поэтому рекомендуется употреблять овощи и фрукты по возможности в сыром виде. Недостаточно магния получают жители районов, где мягкая питьевая вода.Как уже указывалось ранее, источниками магния для организма являются: пища, вода (жесткая), соль. К продуктам, богатым солями магния относятся: крупы (гречневая и пшенная), бобовые (горох, фасоль), арбуз, шпинат, салат, молоко, тахинная халва, орехи. Богаты этим микроэлементом некоторые сорта хлеба – ржаной, и в меньшей степени пшеничный.
Черный шоколад полезен не только известным антиоксидантным и тонизирующим свойством, но и высоким содержанием магния. В мясной продукции содержание магния не так велико, по сравнению с крупами. Совсем немного его содержится в яблоках и сливах. Сухофрукты богаты различными элементами, в том числе и магнием, особенно это относится к кураге, инжиру, бананам. Лидером по содержанию магния является кунжут.
При необходимости с профилактической или лечебной целью назначают препараты магния, которые доступны в аптечной сети без рецепта врача. Однако не рекомендуется самостоятельно начинать прием препаратов без предварительной консультации специалиста. Только он может достоверно определить есть ли необходимость в приеме данных препаратов, и подберет правильный режим приема и дозировку с учетом возраста, физической активности и пола. Часто достаточным оказывается коррекция питания.
Взаимодействие с другими веществами
В организме магний и препараты, содержащие его, взаимодействуют с другими микро и макроэлементами, при этом оказывая синергическое (взаимодополняющее) или антагонистическое (противоположное) действие друг на друга. Так, витамин В6 улучшает усвоение магния и проникновение его внутрь клетки. Соли кальция уменьшают всасывание магния в желудочно-кишечном тракте, если одновременно попадают туда, так как они являются антагонистами.Полезным будет знать, что препараты, содержащие магний снижают всасывание, а, следовательно, и эффективность антибиотиков тетрациклинового ряда. Поэтому рекомендуется соблюсти трехчасовой интервал между приемом этих медикаментов. Таким же образом влияет магний на препараты железа и антикоагулянты, принимаемые внутрь.
| Магний | |
|---|---|
| Атомный номер | 12 |
| Внешний вид простого вещества |
лёгкий, ковкий, серебристо-белый металл |
| Свойства атома | |
|
Атомная масса (молярная масса) |
24,305 а. е. м. ( /моль) |
| Радиус атома | 160 пм |
|
Энергия ионизации (первый электрон) |
737,3 (7,64) кДж/моль (эВ) |
| Электронная конфигурация | 3s 2 |
| Химические свойства | |
| Ковалентный радиус | 136 пм |
| Радиус иона | 66 (+2e) пм |
|
Электроотрицательность (по Полингу) |
1,31 |
| Электродный потенциал | −2,37 В |
| Степени окисления | 2 |
| Термодинамические свойства простого вещества | |
| Плотность | 1,738 г/см³ |
| Молярная теплоёмкость | 24,90 Дж/(K·моль) |
| Теплопроводность | 156 Вт/(м·K) |
| Температура плавления | 922 K |
| Теплота плавления | 9,20 кДж/моль |
| Температура кипения | 1 363 K |
| Теплота испарения | 131,8 кДж/моль |
| Молярный объём | 14,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,210 c=5,21 Å |
| Отношение c/a | 1,624 |
| Температура Дебая | 318 K |
| Mg | 12 |
| 24,305 | |
| 3s 2 | |
| Магний | |
Магний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов, с атомным номером 12. Обозначается символом Mg Magnesium. Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета.
История
Происхождение названия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO 4 · 7H 2 O.
Впервые был выделен в чистом виде сэром Хемфри Дэви в 1808 году.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl 2 (бишофит), натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния:
MgCl 2 (электролиз) = Mg + Cl 2 .
Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много — около 0,1 % примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния, или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс:
или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO 3 ·MgCO 3 , не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
CaCO 3 ·MgCO 3 = CaO + MgO + 2CO 2 ,
2MgO + CaO + Si = Ca 2 SiO 4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
Физические свойства
Магний — очень легкий, довольно хрупкий металл, постепенно окисляется на воздухе, превращаясь в белый оксид магния. Кристаллическая решетка α-формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая, а = 5,56Å. Атомный радиус 1,97Å, ионный радиус Ca2+, 1,04Å. Плотность 1,74 г/см³(20 °C). Выше 464 °C устойчива гексагональная β-форма. t пл = 650 °C, t кип = 1105 °C; температурный коэффициент линейного расширения 22.10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м.К) или 0,3 кал/(см.сек.°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг.К) или 0,149 кал/(г.°C); удельное электросопротивление при 20 °C 4,6.10-8 ом.м или 4,6.10-6ом.см; температурный коэффициент электросопротивления 4,57.10-3 (20 °C). Модуль упругости 26 Гн/м² (2600 кгс/мм²); предел прочности при растяжении 60 Мн/м² (6 кгс/мм²); предел упругости 4 Мн/м² (0,4 кгс/мм²), предел текучести 38 Мн/м² (3,8 кгс/мм²); относительное удлинение 50 %; твердость по Бринеллю 200—300 Мн/м² (20-30 кгс/мм²). Магний достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO 4 — взрывчатое вещество! Раскаленный магний реагирует с водой:
Mg (раск.) + Н 2 О = MgO + H 2 ;
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl 2 + H 2 ;
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида:
2Mg + О 2 = 2MgO;
3Mg + N 2 = Mg 3 N 2
Определение
Серебристо-белый, средний по твердости металл. Средне распространен в природе. При горении выделяется большое количество света и тепла.
Применение
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Цены на магний в слитках в 2006 году составили в среднем 3 долл/кг.
Химические источники тока
Магний в виде чистого металла, а так же его химические соединения (бромид, перхлорат) применяются для производства очень мощных резервных электрических батарей (например магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др), и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др). ХИТ на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением. В последние годы в ряде стран обострилась проблема разработки аккумулятора с большим сроком службы, так как теоретические данные позволяют утверждать очень большие перспективы его широкого использования (высокая энергия, экологичность, доступность сырья).
Соединения
Гидрид магния — один из наиболее емких аккумуляторов водорода, применяемых для его хранения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO 4) 2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с участием магния.
Фторид магния MgF 2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr 2 — в качестве электролита для химических резервных источников тока.
Медицина
Оксид и соли магния применяется в медицине (аспаркам, сульфат магния, цитрат магния, минерал бишофит). Бишофитотерапия использует биологические эффекты природного магния в лечении и реабилитации широкого круга заболеваний, в первую очередь — опорно-двигательного аппарата, нервной и сердечно-сосудистой систем.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, нитрат аммония, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Биологическая роль и токсикология
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений. Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатина фосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Поэтому магний является тем элементом, который контролирует энергетику организма. Магний необходим на всех этапах синтеза белка. Установлено также, что 80—90 % современных людей страдают от дефицита магния. Это может проявляться по-разному: бессоница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС) и прочие симптомы и болезни. А при частом употреблении слабительных, алкоголя, больших психических и физических нагрузках потребность в магнии увеличивается.
К пище, богатой магнием, относятся: кунжут, отруби, орехи. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека. Для получения суточной нормы магния, порядка 300 мг для женщин и 400 мг для мужчин, необходимо выпивать 2—3 литра молока или съедать 1,5—2 кг мяса.
По результатам последних исследований обнаружено, что цитрат магния является наиболее усваиваемым магниесодержащим продуктом.
Установлено, что чтобы усвоить кальций, организму необходим магний. Одним из наиболее биологически целесообразных источников магния при транскутанном (чрезкожном) всасывании является минерал бишофит, широко использующийся в целях медицинской реабилитации, физиотерапии и санаторно-курортного лечения.
Магний, Magnesium, Mg (12)
Название магнезия встречается уже в Лейденском папирусе-Х (Ш в.). Оно происходит, вероятно, от названия города в гористой местности Фессалии — Магнисия. Магнесийским камнем в древности назывались магнитная окись железа, а магнесом — магнит. Эти названия перешли в латинский и другие языки.
Внешнее сходство магнитной окиси железа с пиролизитом (двуокисью марганца) привело к тому, что магнезийским камнем, магнетисом и магне стали называть минералы и руды темной и темно-коричневой окраски, а в дальнейшем и другие минералы. В алхимической литературе слово магнес (Magnes) обозначало многие вещества, например ртуть, эфиопский камень, гераклийский камень. Минералы, rдержащие магний, тоже были известны с глубокой древности (доломит, тальк, асбест, нефрит и др.) и уже тогда находили широкое применение. Однако их считали не индивидуальными веществами, а видоизменениями других, более известных минералов, чаще всего извести.
Установить тот факт, что в магнийсодержащих минералах и солях присутствует особое металлическое основание, помогли исследования минеральной воды Эпсомского источника в Англии, открытого в 1618 г. Твердую соль из горькой эпсомской воды выделил в 1695 г. Грю, указав при этом, что по своей природе эта соль заметно отличается от всех других солей. В XVIII в. эпсомской солью занимались многие видные химики-аналитики — Бергман, Нейман, Блэк и др. Когда в континентальной Европе были открыты источники воды, подобной эпсомской, эти исследования расширились еще больше. По-видимому, Нейман первым предложил называть эпсомскую соль (карбонат магния) белой магнезией в отличие от черной магнезии (пиролюзита). Земля белой магнезии (Magnesia alba) под названием магнезия фигурирует в списке простых тел Лавуазье, причем синонимом этой земли Лавуазье считает «основание эпсомской соли» (base de sel d"Epsom).
В русской литературе начала XIX в. магнезия именовалась иногда горькоземом. В 1808 г. Дэви, подвергая белую магнезию электролизу, получил немного нечистого металлического магния; в чистом виде этот металл был получен Бусси в 1829 г. Вначале Дэви предложил назвать новый металл магнием (Magnium) в отличие от магнезии, которая в то время обозначала металлическое основание пиролюзита (Magnesium). Однако, когда название черной магнезии было изменено, Дэви предпочел называть металл магнезием. Интересно, что первоначальное название магний уцелело только в русском языке благодаря учебнику Гесса. В начале XIX в. предлагались и другие названия — магнезь (Страхов), магнезий, горькоземий (Щеглов).
Магний был впервые обнаружен в районе Фессалия, Греция, и назван Магнезия. Это третий самый распространенный металлический элемент в земной коре, однако он редко в чистом виде из-за того, что легко образует связи с другими элементами. Металлический магний впервые был получен из руды в 1808 году в небольших количествах сэром Хамфри Дэви, а промышленное производство впервые началось в 1886 году в Германии.
Магний является самым легким из всех широко используемых конструкционных материалов с плотностью 1,7 г/см3 (106,13 фунтов /куб.фут), примерно на одну треть легче, чем алюминий и титан, и одна четверть плотности стали. Несмотря на это преимущество, производство первичного магния в 2012 году составило 905 тыс. тонн, только 2,5% производства первичного алюминия (45,2 млн. тонн) и 0,06% производства необработанной стали (1546 млн. тонн). Однако объем производства магния больше, чем титана (211 тыс. тонн).
Небольшие добавки магния в алюминий придают огнестойкость и прочность. Близость магния с серой делает его незаменимым в производстве определенных сортов сырой стали. С помощью магния также восстанавливают металлического титана из тетрахлорида титана в процессе Кролла, а также получают очень качественные сорта чугуна. Вместе на эти четыре сферы приходилось 61% потребления магния в 2012 году. Таким образом, несмотря на свой относительный статус «пескаря» в структуре производства материалов, магний играет центральную роль в изготовлении и использовании конкурирующих металлических продуктов.
Поставки магния
Мировое производство первичного магния, по оценкам Roskill, увеличилось с 499 тыс. тонн в 2002 году до 905 тыс. тонн в 2012 году, среднегодовой темп роста (CAGR) - 6,1%. Производство первичного металла магния ограничивается десятью странами.
Китай продолжает доминировать в производстве первичного металлического магния. Страна произвела более 730 тысяч тонн металла в 2012 году, и на ее долю в этот год пришлось более чем 75% от общего объема поставок. В Китае, однако, имел место сдвиг в производстве. Обильный и дешевый газ в качестве побочного продукта при производстве кокса побудил производителей магния обратить свое внимание на провинцию Шэньси в поисках более высокой прибыли. Это заставило некоторые традиционные магниевые провинции бороться с конкурентами, а в целом в китайской промышленности магния коэффициент использования производственных мощностей едва превышает 50%. Кроме того, в Китае была произведена консолидация в промышленности, и восемь китайских производителей сейчас находятся в топ-10 глобальных производителей.
Несмотря на недавние усилия китайского правительства по консолидации отрасли, большинство китайских производственных мощностей по-прежнему разбросаны на относительно небольших заводах, а консолидация, в основном, происходит на корпоративном уровне. Восемь китайских компаний находятся в топ-10 мировых поставщиков по мощности, которая для каждой превышает 50 тыс. тонн в год, хотя только пять из них в 2011 году произвели более 30 тыс. тонн, а одна закрылась в 2012 году.
Количество компаний с мощностью ниже 50 тыс. тонн, и производством намного меньше, чем 30 тыс. тонн, неизвестно, но Roskill оценивает их число примерно в 50. В совокупности, на эти небольшие заводы пришлось около трети мировых мощностей в 2012 году.

Источник: "Металлический магний: глобальные промышленные рынки и перспективы, 2012 год", Roskill Information Services Ltd.
Несмотря на несколько закрытых предприятий в преддверии спада 2008/09 годов, особенно в Канаде, производство в США, России и Израиля с тех пор увеличилось, хотя и в значительной степени удовлетворяет спрос со стороны растущей промышленности по выпуску металлического титана. Вторичное производство магния более равномерно распространено по всему миру, где США по-прежнему являются переработчиком номер один. Новые заводы по производству первичного магния были открыты в Малайзии и Южной Корее в 2010 году, а Иран должен был последовать их примеру в 2013 году. Ожидаемый запуск электролитического завода Цинхай Солт-Лейк в Китае, мощностью 100 тыс. тонн в год, может еще и изменить расстановку сил в Китае на короткий срок.
Основными производителями первичного магния за пределами Китая являются ВСМПО-Ависма и Соликамский магниевый завод в России; US Magnesium в США; Dead Sea Magnesium в Израиле; Усть-Каменогорский титано-магниевый комбинат в Казахстане; Rima Industrial в Бразилии; CVM Minerals в Малайзии; Magnohrom в Сербии; и POSCO в Южной Корее.
Вторичный магний из переработанных магниевых сплавов, и в качестве компонента переработанных алюминиевых сплавов, является важным источником поставок, в частности, в США, где он составляет около половины от общего объема поставок. Он имеет гораздо меньшее значение в других местах. Мировые мощности и производство вторичного магния (за исключением алюминиевых сплавов, которые образуют цикл с обратной связью) оцениваются Roskill более чем в 200 тыс. тонн в год, при этом около 40% мощностей сосредоточены в США.
Большая часть международной торговли магнием - это экспорт из Китая, на долю которого приходилось половина экспорта необработанного магния (99,8% Mg экспорт необработанной магния в 2012 году. Этот материал в основном импортируют Канада, Япония и Европа. Американский рынок защищен от китайского импорта высокими антидемпинговыми пошлинами, и магний в страну поставляется из Израиля, либо это внутреннее первичное и вторичное производство. По данным Global Trade Atlas, проанализированным Roskill, международная торговля необработанным магния упала с примерно 500 тыс. тонн в 2007 году до 305 тыс. тонн в 2009 году, выросла до 480 тыс. тонн в 2011 году, но немного упала в 2012 году.
Около 50 тыс. тонн отходов и лома было продано в 2012 году (по сравнению с 62 тыс. тонн в 2007 году), и это, в основном, экспорт из Канады, Германии и Австрии и импорт в США, Чехию и Венгрию. Кроме того, примерно 110 тыс. тонн были проданы в 2012 году в виде опилок, стружек, гранул и порошка, при этом, в основном, это экспорт из Китая и импорт в Германию, Турцию и Канаду. Наконец, 37 тыс. тонн кованых изделий были проданы в 2012 году (по сравнению с 46 тыс. тонн в 2011 году), и это, в основном, экспорт из Китая, Австрии и Германии, и импорт в Тайвань, Новую Зеландию и Великобританию.
Спрос на магний
Глобальное видимое потребление (производство + импорт - экспорт) магния, достигло 1050 тыс. тонн в 2007 году, среднегодовой темп роста 8% по сравнению с 630 тыс. тонн, потребленными в 2001 году. Потребление первичного металлического магния сократилось на 7% в 2008 году и еще на 15% в 2009 году, упав ниже 690 тыс. тонн, так как мировой экономический кризис привел к значительному снижению спроса на содержащие магний продукты.
Однако рынок восстановился, превысив уровень 2007 года в 2011 году и показав новый пик спроса в 2012 году. Вторичное использование магния дополнительно увеличило потребление, а общий объем потребления магния превысил 1 млн. тонн в 2007 году и 1,1 млн. тонн в 2012 году.
Китай доминирует в мировом потреблении с объемом в 340 тыс. тонн в 2012 году, 33% от общего объема. Другие крупные рынки для магния - это Северная Америка (23% мирового потребления) и Европа (18%). Россия и Япония также крупные потребители, на их долю в совокупности приходится 12%.
Исторически сложилось так, что алюминиевые сплавы являются основной сферой применения магния во всем мире, хотя в 2012 году объем потребления магния в этой конечной сфере потребления и объем потребления магния в сплавах для литья под давлением сравнялись, при этом на каждую сферу приходилось около 365 тыс. тонн, или 33% от общего объема потребления. Упаковочная промышленность является крупнейшим рынком для магния в алюминиевых сплавах, затем следует транспорт, строительство и потребительские товары длительного пользования.
Автомобильная промышленность на сегодняшний день является крупнейшим потребителем компонентов литого магния. Литье под давлением из магниевого сплава используется для корпусов, узлов, кронштейнов и других компонентов для всех слоев автотранспортных средств. Среднее применение магния на автомобиль в 2012 году было 2,3 кг, а в некоторых моделях достигало 26 кг. Магний применяется в изготовлении литых корпусов для устройств связи (например, мобильные телефоны и смартфоны), ноутбуков, планшетных компьютеров и другого электронного оборудования. Это является второй по величине сферой использования литого магния, после автомобилей.
Производство титановой губки (т.е. сырого металлического титана) было третьей по величине сферой потребления магния, на которую приходилось около 123 тыс. тонн или 11% от общего мирового потребления в 2012 году, а десульфуризация стала четвертой по величине сферой использования, с объемом 119 тыс. тонн в 2012 году. Использование магния в сталеплавильном производстве уменьшилось в последние годы, в связи с глобальным экономическим кризисом и, как следствие, замедлением роста (или снижением) производства стали во многих странах. В среднем, в мире используется примерно 50 г/т стали.

Источник: "Металлический магний: Глобальные промышленные рынки и перспективы, 2012 год", Roskill Information Services Ltd.
Магний также используется в других приложениях, например, как сфероидизирующий модификатор для чугуна и как катодная защита, способ предотвращения коррозии, вынуждающий все поверхности металлической структуры быть катодами через предоставление внешних анодов активных металлов. По оценкам Roskill, использование магния для этих двух приложений было порядка 65 тыс. тонн и 60 тыс. тонн в 2012 году.
В то время как рост производства автомобилей в некоторых регионах повысил потребление с 2008/09 спада, рынок был несколько сдержан снижением европейских поставок транспортных средств. Тем не менее, в результате давления от сокращения выбросов, рост использования магния в транспортной сфере продолжает опережать использование металла в традиционных материалах, такие как сталь, и рынок литья под давлением, как прогнозируется, будет расти на 6-7% в год до 2017 года. В алюминиевых сплавах, магний используется преимущественно в упаковках, а этот рынок продолжает показывать сильное расширение, ввиду экономического роста в развивающихся странах.
Облегчение веса автомобилей и Китай стимулируют рост спроса на магний
По оценкам Roskill, потребление магния достигло нового пика в 2012 году, 1,1 млн. тонн, при этом спрос увеличивался на 5,5% в год в течение последнего десятилетия. Крупнейшими отраслями-потребителями магния остаются промышленность литья под давлением и алюминиевые сплавы, на каждую из которых приходится треть от общего потребления. Транспортная промышленность является крупнейшим потребителем литья и вторым крупнейшим потребителем металла, после алюминиево-магниевых сплавов в упаковках.
Промышленность магния имеет выгоду от роста автомобильного производства, во главе с Китаем, а также повышения удельного расхода магния в автомобилях, так как производители стремятся соответствовать введенным государственным целевым показателям сокращения выбросов, а рост стоимости топлива влияет на потребительские покупательные тенденции. Постоянные усилия по снижение веса означают, что рост потребления магния будет продолжаться, по крайней, на 5,0% в год до 2017 года. Использование магния в литых деталях, скорее всего, будет расти быстрее, на 6,5% в год, но рынок будет сдерживаться более низкими темпами роста десульфурации и сфероидизирующего отжига стали.
Рост китайского потребления более чем компенсировал небольшое падение в остальных странах мира с 2007 года, а на Азию в 2012 году приходилось 43% от общемирового объема по сравнению с 35% пять лет назад. На долю Северной Америки приходилось 20% потребления, а Европы - 15%. Индия и Южная Корея показали уверенный рост потребления за последние пять лет, но при низкой базе в натуральном выражении, в то время потребление в России выросло почти в два раза, в связи с увеличением производства титана. Азия, точнее Китай, будут по-прежнему демонстрировать самые высокие темпы роста спроса на магний на региональной основе до 2017 года.
Китай доминирует в глобальных поставках, но внутренняя конкуренция часто упускается из виду
В производстве первичного магния продолжает доминировать Китай, на долю которого, по оценке Roskill, приходилось 75% мирового производства в 2012 году. России и США вместе представляют собой еще 16%, далее следуют более мелкие производители - Израиль, Казахстан, Бразилия, Сербия и Украина. Малайзия и Южная Корея вышли на рынок в последние годы, хотя и в небольшом масштабе, но это и некоторые ограниченное расширение существующих операций сделали немного, чтобы ослабить растущую долю Китая. Вторичный магния, производство которого в 2012 году составило 211 тыс. тонн, поступает в основном из лома литья. Северная Америка является основным источником вторичного магния, затем следует Европа, так как эти регионы по-прежнему являются крупными потребителями продукции на основе магния.
Лидирующие позиции Китая в первичном производстве магния отражают внутренняя доступность и низкая стоимость ферросилиция и энергии (в виде угля, кокса и электроэнергии), которые являются основными компонентами энергоемкого, теплового пиджинг-процесса получения металла. Тем не менее, столкнувшись с ростом цен на энергоносители и государственным давлением с целью снижения выбросов, китайские магниевые компании вложились в оптимизацию процесса с целью снижения затрат. Хотя Китай часто рассматривается как единое целое в случае с поставками магния, во внутренней промышленности также сильно выросла конкуренция, в связи с недавним повышением доступности кокс газа, в результате перемещения внутреннего производства в провинцию Шэньси, что ограничило рост в провинциях Шаньси и Нинся, и в результате потерь в производстве в других местах.
Низкие капитальные издержки в переходе от стендовых технологических установок означают, что перемещение отечественного производства из провинции в провинцию происходит относительно просто, но приводит к значительному росту мощностей. Roskill оценивает китайские первичные мощности в размере 1,3 млн. тонн, но из них только 0,8-0,9 млн. тонн используются; остальные мощности законсервированы или неэкономичны. Эта тенденция привела к закрытию, по крайней мере, одного крупного производителя в Китае в 2012 году, а также к консолидации отрасли.
Несмотря на ценовую конкурентоспособность и избыточные мощности в Китае, новый электролитический завод в провинции Цинхай, мощностью 100 тысяч тонн, который должен открыться в ближайшее время, мог бы еще больше изменить внутренний ландшафт. Несколько компаний, использующих новые процессы или вариации из существующих электролитических и термических методов, также продолжают исследовать возможность первичного производства магния в других странах, особенно в Австралии и Канаде. Однако, пока эти проекты не смогут конкурировать с китайскими производственными издержками и быть экономически выгодными при текущих и прогнозируемых ценах на магний в 2500-3000 долл./т, Китай, похоже, будет постепенно увеличивать свою долю рынка по мере того, как спрос растет.
Цены на магний
В мире нет площадок для торговли магнием и поэтому в большинстве случаев условия контрактов согласовываются напрямую между производителями и потребителями. Тем не менее, большой объем китайского материала продается на спотовой основе торговцами и китайскими производителями на европейский, японский и внутренний рынок. Основными рыночными ценами на магний, следовательно, являются китайские внутренние и экспортные цены на металл с чистотой 99,8% Mg, и европейские цены экс-Роттердам склад. Некоторые поставки магния происходят за пределами торговли Китая с другими странами, но они образуют меньшую часть от общего открытого рынка.
Рост спроса, в частности, в Китае, привел к быстрому росту цен в четвертом квартале 2007 года и первом полугодии 2008 года. На пике своего роста в первой половине 2008 года цены выросли выше 6000 долл./т FOB Китай для слитка магния с чистотой 99,8%. В последующие годы цены с отступили на более низкие уровни, движимые сокращением потребности в связи с глобальным экономическим кризисом, хотя по-прежнему находились выше, чем до пика 2007/08 годов. Отмена 10% экспортной пошлины на китайские поставки в конце 2012 года вызвала волновой эффект как для европейских цен, так и для китайских экспортных цен, обусловив с 2013 года цены 2500-3000 долл./т FOB Китай. Из-за антидемпинговых пошлин на китайский материал, в США магний продается с премией.