Оксиды. Основания. Калийные удобрения: для чего нужны, виды, как и для каких растений использовать
Cтраница 1
Окись калия, глинозем и кремнекислота (в миллимолях), выщелачиваемые из калиевого полевого-шпата (сплошные кривые) и лейцита (пунктирные) растворителем с рН 3 в зависимости от объема растворителя.
Окись калия вносится в печь с сырьем и топливом в количестве 11 94 г на 1 кг клинкера. Из этого количества лишь 1 23 г К2О удаляется из печной системы и материала с газами и неуловленной пылью; большая же часть щелочи (10 71) остается в клинкере.
Реакция настолько экзотермична, что газ водорода и сам металл горят. Калий горит ярко-красным пламенем до белого оксида калия, который мы видим на фотографиях в виде плавающего дыма. Несколько капель раствора фенолфталеина могут быть добавлены к воде в тарелке, которая окрашивает красные кровяные клетки при контакте калия с водой с полученным гидроксидом калия. Эксперимент относительно безопасен, если используется для реакции мелких фрагментов калия, при нанесении более крупного кусочка, несомненно, взорвется и расплавится, калий может разбрызгиваться на значительные расстояния.
Окиси калия и натрия снижают температуру плавления сырьевой смеси, но отрицательно влияют на качество цемента. Большая часть щелочных окислов входит в состав стекловидной фазы и образует твердые растворы с минералами цемента.
Окись калия вводится в стекольную шихту в виде поташа Поташ применяют для изготовления лучших сортов посудного стекла, хрусталя, оптических стекол. Калийные стекла обладают блеском и прозрачностью.
Разрешается использовать в органическом сельском хозяйстве необработанную калиевую соль
Расплавленный калий в контакте с влажной кожей, безусловно, будет вести себя так же, как и вышеприведенные фотографии, вызывающие действительно серьезные ожоги, не говоря уже о воздействии ожогов глаз. Поэтому защитные очки абсолютно необходимы. Содержание калия в этом необработанном продукте является наиболее распространенным. Содержание калия в необработанной калиевой соли сравнимо с содержанием сульфата калия.
Сырая калиевая соль, где купить и какова ее цена?
Прежде чем покупать, он должен знать, сколько калия содержит минерал, потому что различия могут быть значительными. Он также напоминает нам, что в ближайшем будущем возможно, что калиевая соль будет добыта в Польше недалеко от залива Шак и Силезии.
Кайнитское удобрение, где его купить и какова его цена
Состав каннита изготовителем.Окись калия аналогично окиси натрия вводится через полевые шпаты, а для фриттованной глазури КаО часто применяется и Б виде поташа К2СО3, иногда в виде селитры K NO3, главным образом для целей окисления.
Окись калия КаО по влиянию на свойства эмалевых покрытий подобна окиси натрия.
Окись калия придает глазурям несколько большую тугоплавкость и вязкость, чем окись натрия.
Исходя из количества в элементарной форме, это будет. Это типичное удобрение для пастбищ и поэтому рекламируется. Вы не удивлены этой информацией? Однако стоит знать, какова естественная среда возникновения дикой свеклы. Это прибрежные песчаные дюны и другие районы морского побережья.
Содержание натрия и калия в морской соли
Весовое соотношение между двумя катионами в морской соли составляет 28: Содержание натрия в калии в каитите составляет 2, 2: Конечно, свекла должна быть удобрена, учитывая, что 1 кг хлорида калия можно заменить в большинстве метаболических процессов 0, 8 кг хлорида натрия.
Окись калия может быть получена при осторожном нагревании в ограниченном объеме воздуха; перекись калия КзОд образуется при нагревании калия в избытке кислорода. Перекись кали-я представляет собой желтый порошок и является сильным окислителем.
| Кристаллиты железа в тонком слое восстановленного катализатора (электронномикроско пическая фотография реплики, X 50 000. |
Окись калия играет различную роль - она увеличивает удельную активность поверхности железа, но в то же время имеет тенденцию уменьшать поверхность железа. Для нее также существует оптимальная концентрация (около 0 8 % К2О для катализатора 35 - 4) и соответствующая максимальная активность. Окись калия не растворяется в магнетите во время процесса плавления.
Если да, введите комментарии!
Все, что вам нужно сделать, это втирать и разбросать поле! Это лекарство содержит экстракты натуральной свиной свиньи. Таким образом, у него есть все 5 естественных тиреоидных гормонов щитовидной железы, а не как у синтетических людей, только 1 или максимум. Окисление - это процесс, при котором атом или ион увеличивает свою положительную валентность или уменьшает свою отрицательную валентность из-за потери определенного числа электронов.
Его можно получить прокаливанием гидроксида алюминия
Элемент, который теряет электрон, окисляется. Процесс протекает в присутствии реагента, способного захватывать потерянные электроны, что уменьшается в этом процессе. Он состоит из двух кристаллических модификаций, которые содержатся в следующем отчете.
Окись калия получают в трубке (рис. 69), имеющей изгибы и перетяжки. Калий очищают от покрывающей его корки и в количестве 3 - 4 г помещают в первое колено трубки. Перед суженным отверстием трубки устанавливают мелкую железную, никелевую или медную сетку. Предварительно воздух из трубки вытесняют чистым азотом или аргоном. Затем калий расплавляют и, несколько наклонив трубку, расплавленный калий переводят во второе колено трубки. Окислы, карбонаты и другие примеси остаются на металлической сетке. Затем над расплавленным калием пропускают слабый ток кислорода, который предварительно осушают в колонке с фосфорным ангидридом. Получается по внешнему виду пористая, отчасти блестящая масса, состоящая из окиси калия и пропитывающего ее металлического калия.
Белое вещество, едва ли нечеткое, слабо растворимое в воде и кислотах. Его вводят в раствор путем плавления с сульфатом калия, когда он переходит в растворимый оксид алюминия или гидроксид натрия, когда он переходит в растворимый алюминат натрия. Оксид кальция и диоксид углерода получают термическим разложением известняка. Оксид кальция - известковая известь - используется в строительстве, в сельском хозяйстве; в производстве аммиака, известкового хлорида, нитрата кальция, карбида; в очистке сахарного сока на сахарных заводах; в дублении; в металлургической промышленности; в стекольной промышленности и т.д.
Окись калия не входит в эту группу окисей, но образует с окисью натрия особую группу, так же как и окиси свинца, ртути и серебра.
Вариант 1
1. Даны вещества: гидроксид натрия, соляная кислота, оксид кальция, вода. Какие из этих веществ будут взаимодействовать между собой? Напишите уравнения реакций и назовите образующиеся вещества.
Кальцинирование карбоната кальция, смешанного с каютами, производится промышленно в вертикальных печах. Окись кальция реагирует с водой с тепловыделением, образуя гидроксид кальция. Тепло сочетается с оксидами, с образованием соли. Использование извести, карбида кальция в качестве основного агента в металлургии.
В небольших количествах он содержится в некоторых вулканических газах. Его получают кислым действием. Серной кислоты на муравьиную кислоту или щавелевую кислоту. Окись углерода очень токсична даже в небольших количествах: если она вдохновлена, она реагирует с гемоглобином в крови, не позволяя ему переносить кислород в клетки организма.
2. Приведите два примера реакции нейтрализации. Почему эта реакция носит такое название?
Реакция нейтрализации – реакция между кислотой и основанием с получением соли и воды. Так называется потому, что в результате исходная щелочная или кислая среда нейтрализуется и становится нейтральной.
3. Вычислите массу оксида меди (II), образующегося при разложении 49 г гидроксида меди (II).
Промышленные, большие количества двуокиси углерода образуются в генераторном газе и водяном газе. Это бесцветный, без запаха, с трудом сжиженный газ, плохо растворимый в воде, токсичный. Окись углерода реагирует горячей с гидроксидом натрия или калия, что приводит к следующим образованиям.
С кислородом он образует углекислый газ. Реагирует с парами горячей воды. Он уменьшает количество оксидов металлов до металла. В других реакциях диоксид углерода может действовать как окислитель, например. Натрий и магний. Реакция с водородом, приводящая к различным продуктам, в зависимости от условий. Таким образом, в присутствии металлического никеля он приводит к метану.
Вариант 2
1. Определите, к какому классу относится вещество, имеющее формулу CaO. Назовите его. Напишите уравнения двух химических реакций, наиболее ярко характеризующих его свойства как представителя указанного вами класса.
2. На какие две группы делят основания? Приведите примеры формул тех и других оснований и назовите их.
Из-за дублета электронов, которые не являются частью атома углерода, оксид углерода может функционировать как лиганд в сложных комбинациях. Двуокись углерода - двуокись углерода содержится в воздухе и газированных водах. Плотность больше, чем воздух, растворимый в воде, с которым он частично объединяется. В этом состоянии он хранится в стальных баллонах. Углекислый газ не горит и не поддерживает горения и жизни.
Подготовка мешка для белья; производство газированных напитков; исчезновение поджога. Лечение заболеваний. Он находится в форме кристаллического твердого вещества, от белого до желтоватого, молекулярного веса 94, энергично реагирует с водой и двуокисью углерода, образуя гидроксид, соответственно карбонат калия.
3. В реакцию с азотной кислотой вступило 20 г гидроксида натрия. Рассчитайте массу образовавшейся соли.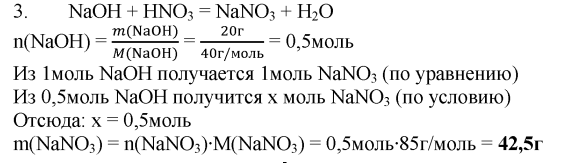
Вариант 3
1. Даны вещества: оксид калия, гидроксид кальция, серная кислота, вода. Какие из этих веществ будут взаимодействовать между собой? Напишите уравнения реакций и укажите названия образующихся веществ.
Он представлен в виде твердого, кристаллического белого вещества, молекулярного веса 61, легко реагирует с водой и с двуокисью углерода. Диоксид серы - в газообразном состоянии используется в качестве сырья для производства серной кислоты в качестве отбеливателя для текстильных волокон в качестве дезинфицирующего средства.
Углерод, нефть и природный газ также содержат соединения серы. Сжигается диоксид серы. Этот газ атакует легкие, вызывая астму. Растворяя двуокись серы в дождевой воде, образуются кислотные дожди, затрагивающие структуры, растения и убивающие рыбу и другие водные организмы.
2. Как опытным путем определить, является ли выданный вам раствор раствором кислоты или щелочи? Ответ подтвердите конкретным примером.
Необходимо опустить лакмусовую бумажку: в растворе кислоты она покраснеет, а в щелочном растворе станет синей.
3. Рассчитайте массу оксида кальция, необходимого для получения 37 г гидроксида кальция.
Двуокись кремния - в виде песка используется для получения строительных материалов. Кварцевого стекла, для получения различных соединений кремния, в оптической промышленности, в металлургии. Является четвертым минералом, который присутствует в организме и «ответственен» за зеленый цвет растений и зеленых овощей. Однако мало кто ценит важность этого чудесного минерала.
И до сих пор мы знаем, что эти основные минералы используют более 350 биохимических процессов в организме, обеспечивая оптимальное функционирование. Растения зеленые из-за молекулы хлорофилла, которая имеет поразительное сходство с человеческим гемоглобином.
Вариант 4
1. Определите, к какому классу относится вещество, имеющее формулу P₂O₅. Назовите его. Напишите уравнения двух химических реакций, наиболее ярко характеризующих его свойства как представителя указанного вами класса.
2. Вам выданы две пробирки с белыми порошкообразными веществами. Известно, что в одной из пробирок содержится Ba(OH)₂, а в другой – Zn(OH)₂. Как опытным путем можно распознать эти вещества?
Проверить на растворимость в воде: гидроксид бария в воде растворим, а гидроксид цинка – нет.
Вот семь причин, почему вы должны есть больше растений, богатых магнием
Согласно статистике неврологическими специалистами и специалистами по мигрени, каждый пятый человек из Запада ежегодно страдает формой мигрени. Человек в возрасте 25 лет будет страдать от головных болей не менее 15 дней в месяц. Эти изнурительные атаки включают острую головную боль, особенно с одной стороны, сопровождающуюся импульсами и светочувствительностью. Они также могут сопровождаться заложенностью носа, размытым мышлением и тошнотой.
В исследовании 133 пациентов с мигренью добавление 500 мг оксида магния всего за 12 недель значительно улучшило частоту и тяжесть мигрени. И они в семь раз чаще умирают по другим причинам. Это полезно для диабетиков. . Дефицит магния часто встречается у диабетиков 2-го типа, особенно при невропатии или болезни коронарных артерий.
3. К раствору сульфата меди (II) прилили раствор, содержащий 10 г гидроксида натрия. Рассчитайте массу образовавшегося осадка.




