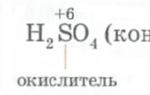Ртуть и её соединения. Углеродная зависимость: как изменение арктической флоры повлияет на климат в регионе Строение атома ртути
Введение
Ртуть (лат. Hudrargyrum) – химический элемент 2 группы периодической системы Менделеева; атомный номер 80, атомная масса 200,59. Ртуть – тяжелый (плотность 13,52 г/см3) металл серебристо-белого цвета, единственный металл, жидкий при обычных условиях. При нагревании ртуть довольно сильно расширяется, плохо проводит электрический ток и тепло – в 50 раз хуже серебра.
Многие металлы хорошо растворяются
в ртути с образованием амальгамы.
Получение ртути
Ртутные руды содержащие ртуть в виде киновари, подвергают окислительному обжигу.
HgS + O2 = Hg + SO2
Обжиговые газы, пройдя пылеуловительную камеру, поступают в трубчатый холодильник из нержавеющей стали или монель-металла. Жидкая ртуть стекает в железные приёмники. Для очистки сырую ртуть пропускают тонкой струйкой через высокий (1 – 1,5 м) сосуд с 10%-ной HNO3, промывают водой, высушивают и перегоняют в вакууме. Разработаны способы извлечения ртуть электролизом сульфидных растворов.
Распространение Ртути в природе
Ртуть принадлежит к числу весьма редких элементов. Приблизительно в таких количествах она содержится в изверженных горных породах. Важную роль в геохимии играет её миграция в газообразном состоянии и в водных растворах. В земной коре ртуть преимущественно рассеяна; осаждается из горячих подземных вод, образуя ртутные руды (содержание ртуть в них составляет несколько процентов), Известно 35 ртутных минералов; главнейший из них – киноварь HgS.
В биосфере ртуть в основном рассеивается и лишь в незначительных. количествах сорбируется глинами и илами (в глинах и сланцах в среднем 4.10–5%). В морской воде содержится 3.10–9% ртути.
Самородная ртуть, встречающаяся в природе, образуется при окислении киновари в сульфат и разложении последнего, при вулканических извержениях (редко), гидротермальным путём (выделяется из водных растворов).
Историческая справка
Самородная ртуть была известна за 2000 лет до и. э. народам Индии и Китая. Ими же, а также греками и римлянами применялась киноварь (природная HgS) как окраска, лекарственное и косметическое средство. Алхимики считали ртуть главной составной частью всех металлов. “Фиксация” ртути (переход в твердое состояние) признавалась первым условием ее превращения в золото. Твёрдую ртуть впервые получили в декабре 1759 петербургские академики И. А. Браун и М. В. Ломоносов. Ученым удалось заморозить ртуть в смеси из снега и концентрированной азотной кислоты. В опытах Ломоносова отвердевшая ртуть оказалась ковкой, как свинец. Известие о “фиксации” ртуть произвело сенсацию в ученом мире того времени; оно явилось одним из наиболее убедительных доказательств того, что ртуть – такой же металл, как и все прочие.
Применение
Ртуть широко применяется при изготовлении научных приборов (барометры, термометры,манометры, вакуумные насосы и др.), в ртутных лампах, переключателях, выпрямителях; как жидкий катод в производстве едких щелочей и хлора электролизом, в качестве катализатора при синтезе уксусной кислоты, в металлургии для амальгамации золота и серебра, при изготовлении взрывчатых веществ; в медицине (каломель, сулема, ртутьорганические и др. соединения), в качестве пигмента (киноварь), в сельском хозяйстве (органические соединения ртути) в качестве протравителя семян и гербицида, а также как компонент краски морских судов (для борьбы с обрастанием их организмами). ртуть и ее соединения токсичны, поэтому работа с ними требует принятия необходимых мер предосторожности.
Отравления
Основной опасность представляют пары металлической ртути, выделение которых с открытых поверхностей возрастает при повышении температуры воздуха. При вдыхании ртуть попадает в кровь. В организме ртуть циркулирует в крови, соединяясь с белками; частично откладывается в печени, в почках, селезенке, ткани мозга и др. Токсическое действие связано с нарушением деятельности головного мозга (в первую очередь, гипоталамуса). Из организма ртуть выводится через почки, кишечник, потовые железы и др. Острые отравления ртути и её парами встречаются редко. При хронических отравлениях наблюдаются эмоциональная неустойчивость, раздражительность, снижение работоспособности, нарушение сна, дрожание пальцев рук, снижение обоняния, головные боли. характерный признак отравления – появление по краю дёсен каймы сине-черного цвета.
Работа может использоваться для проведения уроков и докладов по предмету "Химия"
Готовые презентации по химии включают в себя слайды, которые учителя могут использовать на уроках химии для для изучения химических свойств веществ в интерактивной форме. Представленные презентации по химии помогут учителям в учебном процессе. На нашем сайте Вы можете скачать готовые презентации по химии для 7,8,9,10,11 класса.
Слайд 2
Введение
Ртуть (Hg, от лат. Hydrargyrum) - элемент шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80, относящийся к подгруппе цинка (побочной подгруппе II группы).
Слайд 3
Простое вещество ртуть - переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты.
Слайд 4
Ртуть - один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент -бром).
Слайд 5
История
Ртуть известна с древних времен. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари.
Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы.
Слайд 6
Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 г.
Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства: ковкость, электропроводность и др.
Слайд 7
Нахождение в природе
- Ртуть - относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами.
- Наиболее богатые ртутью руды содержат до 2,5 % ртути.
Слайд 8
- Основная форма нахождения ртути в природе - рассеянная и только 0,02 % её заключено в месторождениях.
- В водах Мирового океана содержание ртути 0,1 мкг/л.
Слайд 9
Физические свойства
- Ртуть - единственный металл, который находится в жидком состоянии при комнатной температуре.
- Температура плавления составляет 234,32 K (-38,83 °C), кипит при 629,88 K (356,73 °C).
- Обладает свойствами диамагнетика.
Слайд 10
- Образует со многими металлами жидкие и твёрдые сплавы - амальгамы.
- Стойкие к амальгамированию металлы: V, Fe, Mo, Cs, Nb, Ta, W.
- Плотность ртути при нормальных условиях - 13 500 кг/м3.
Слайд 11
Химические свойства
- Для ртути характерны две степени окисления: +1 и +2.
- В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ со связью металл-металл.
- Ртуть - один из немногих металлов, способных формировать такие катионы, и у ртути они - самые устойчивые.
Слайд 12
Ртуть - малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке и азотной кислоте:
Слайд 13
Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути. При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg2(NO3)2.
Слайд 14
При нагревании до 300 °C ртуть вступает в реакцию с кислородом. При этом образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ.
Слайд 15
Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода. При нагревании ртути с серой образуется сульфид ртути(II):
Слайд 16
Ртуть также реагирует с галогенами (причём на холоде - медленно). Ртуть можно окислить также щелочным раствором перманганата калия и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.
Ну очень удивительное вещество, обладающее всеми основными свойствами металлов. Вот только форму предать ему проблематично.
Представляем Вам интересные факты о ртути.
1). Знаете ли вы, что ртуть - это единственный металл, который постоянно пребывает в жидком состоянии при привычной для нас температуре окружающей среды?

2). Ртуть является хорошим проводником электричества.

Именно поэтому этот металл добавляют в контакт выключателей.
3). Ртуть не совместима лишь с двумя металлами - железо и платина. С остальными же она вполне "неплохо ладит" и создает смешанные сплавы со своим участием.

4). Ртуть получают из такой руды, как киноварь путем нагревания. Таким образом из киновари выделяется ртуть.

5). Ртутные соли обладают массой полезных свойств. Так, из хлористой соли делают антисептические средства, из фульмината - взрывчатые боеприпасы.

6). Знаете ли вы, как еще называют ртуть? "Живое серебро" - это название прижилось к металлу из-за его цвета и "двигательных возможностей".

7). Все знают о токсичности и вреде ртути. Однако, на практике существуют совсем иные показатели. Так, некоторые люди, решившие покончить жизнь самоубийством посредством ртути, вводили ее через вены или же просто пили. Результатом такового не была смерть.
Более того, пострадавшие прожили более 10 лет и умерли от совершенно иных заболеваниях. Получается, опасность ртути преувеличена?

8). Ранее металлическую ртуть использовали для лечения заворота кишок. Однако, в течение постановки таких экспериментов было выявлено, что эффективность данного лечения стремиться к нулю, а вот риск получить разрыв желудка - к 10 из 10. От применения такого ртутного лекарства пришлось отказаться.

9). Ртуть участвует в переработке нефти. Так, с помощью именно этого металла, можно регулировать оптимальную температуру для процесса, который играет главенствующую роль для нефти.

10). Ртуть является очень тяжелым металлом. Так, если налить в 1 л флягу ртуть, то масса таковой получиться почти 7 кг.

11). Ранее ртуть даже входила в некоторые препараты "слабительного" действия. Единственный минус такового - если организм "не отдаст свои переработки" будет сильнейшее ртутное отравление.

Другие интересные факты о ртути Вы найдете Web страницах сети Интернет.
«Знаки химических элементов» - Знаете ли вы. Химический элемент. Водород. Анаграмма. Древнегреческие мудрецы. Элементы. Шуточные вопросы. Менделевий. Метограмма. Йенс-Якоб Берцелиус. Поиграем. Таблица относительных весов. Знаки химических элементов. Уран. Сера. Относительная атомная масса. Читая Менделеева. Титан. Понятие химического элемента.
«Никель» - Производство различных сплавов. Основная причина аллергии. Немецкий химик Иеремия Рихтер. Ковкий и пластичный металл. Горит никель только в виде порошка. Является основным компонентом метеоритов. Никель. Является основой большинства суперсплавов. Применяется во многих отраслях народного хозяйства. Цвет никеля.
«Получение и свойства водорода» - С металлами водород является окислителем. Строение обусловливает разнообразие свойств. Если в реку бросить кусок натрия. Физические свойства. Применение. Тестирование на ПК. Применение и значение водорода. Мыльные пузыри. Получение водорода. Водород входит в состав основного вещества Земли - воды. Не шутите с водородом.
«Значение цинка» - Цинк. Вымывание. Недостаток цинка. Цинкование. Значение цинка для человека. Значение цинка. Суточная потребность цинка. Содержание цинка. Признаки нехватки цинка. Потеря аппетита. Дефицит цинка у детей.
«Знаки элементов» - Химический элемент. Имена великих ученых. Координаты. Литий. Астрономические начала. Фтор. Металлы. Cера. Понятие о знаках химических элементов. Водород. Знаки химических элементов. Подгруппы. Мифы древних греков. Географические начала. Малые периоды. Йёнс Якоб Берцелиус. Свойства элементов. Период.
«Химический элемент алюминий» - Физические свойства. Темные пятна. Незнакомец. Химические свойства. Применение. Посуда из алюминия. На каких свойствах алюминия основано его применение. Состав. Алюминиевая посуда. Какими физическими свойствами обладает алюминий. Алюминий. Цепочки превращений.
Всего в теме 46 презентаций
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
Опасная химия Презентация разработана учителем –логопедом ГОУ АО «Онежская СКОШИ» Савиной Е.В.
Выводы по теме «Осторожно, ртуть!»: Ртуть- очень ядовитый материал, который попадает в организм человека при вдыхании ядовитых паров или употреблении в пищу заражённых ртутью продуктов. Внешний вид ртути: серебристые блестящие капли, тяжёлые и подвижные. Ртуть растекается по поверхности, рассыпается на мелкие шарики и снова собирается вместе. Ртуть используется в лампах дневного света и термометрах. Если разбился термометр, то собирать веником, пылесосом, руками запрещается. Твои действия: Открыть балкон, окно, форточку в помещении, где разлилась ртуть; Выйти из комнаты и плотно закрыть за собой дверь; Обязательно рассказать взрослым. Уборкой должны заниматься только взрослые.
Если разбился градусник… 1.Окна и форточки в помещении, где разлилась ртуть. 2.Спринцовкой, шприцом или пипеткой собрать ртуть в банку с водой (собирать от края к центру). 3.Закрыть ёмкость с ртутью плотной крышкой. 4.Обработать место, где была разлита ртуть (кафель, линолеум, крашенный пол вытирают мокрой газетой, а затем- раствором марганцовки; ковёр, ковролин вынести на открытый воздух и держать там не менее2-х недель). 5.Пипетки, шприцы, спринцовки и ткани, которыми вытирали пол помещаются в герметичную ёмкость и сдаются в службу спасения.
Выводы по теме «Опасная химия»: Вся бытовая химия и лекарства опасны для человека, значит существуют определённые правила при работе с ними: 1.Никогда не пользуйтесь незнакомыми препаратами бытовой химии; 2. Не пей жидкость из бутылок и банок без этикеток, особенно если они спрятаны и стоят в укромном месте; 3.Никогда не пробуй жидкости и таблетки, даже если они похожи на леденцы и приятно пахнут! 4.Не пользуйся спичками и открытым огнём рядом с банками или бутылками с резким запахом; 5.Увидев, что краску или лак перелили в другую бутылку, сделай на ней надпись; 6. Аэрозольные баллончики храни в вертикальном положении в прохладном месте. Не распыляй их содержимое вблизи открытого огня. 7. Перед использованием любого химического препарата всегда внимательно прочитай инструкцию.