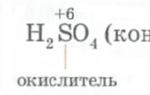Дать характеристику основанию cu oh 2. Основания (основные гидроксиды)
Металла и гидроксильной группы (ОН). Например, гидроксид натрия - NaOH , гидроксид кальция - Ca (OH ) 2 , гидроксид бария - Ba (OH ) 2 и т.д.
Получение гидроксидов.
1. Реакция обмена:
CaSO 4 + 2NaOH = Ca(OH) 2 + Na 2 SO 4,
2. Электролиз водных растворов солей:
2KCl + 2H 2 O = 2KOH + H 2 + Cl 2 ,
3. Взаимодействие щелочных и щелочно-земельных металлов или их оксидов с водой:
К + 2 H 2 O = 2 KOH + H 2 ,
Химические свойства гидроксидов.
1. Гидроксиды имеют щелочной характер среды.
2. Гидроксиды растворяются в воде (щелочи) и бывают нерастворимыми. Например, KOH - растворяется в воде, а Ca (OH ) 2 - малорастворим, имеет раствор белого цвета. Металлы 1-ой группы периодической таблицы Д.И. Менделеева дают растворимые основания (гидроксиды).
3. Гидроксиды разлагаются при нагреве:
Cu (OH ) 2 = CuO + H 2 O .
4. Щелочи реагируют с кислотными и амфотерными оксидами :
2KOH + CO 2 = K 2 CO 3 + H 2 O.
5. Щелочи могут реагировать с некоторыми неметаллами при различных температурах по-разному:
NaOH + Cl 2 = NaCl + NaOCl + H 2 O (холод),
NaOH + 3 Cl 2 = 5 NaCl + NaClO 3 + 3 H 2 O (нагрев).
6. Взаимодействуют с кислотами:
KOH + HNO 3 = KNO 3 + H 2 O .
Основания, амфотерные гидроксиды
Основания - это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп (-OH). Общая формула Me +y (OH) y , где у - число гидроксогрупп, равное степени окисления металла Me. В таблице представлена классификация оснований.

Свойства щелочей гидроксидов щелочных и щелочноземельных металлов
1. Водные растворы щелочей мылкие на ощупь, изменяют окраску индикаторов: лакмуса - в синий цвет, фенолфталеина - в малиновый.
2. Водные растворы диссоциируют:
3. Взаимодействуют с кислотами, вступая в реакцию обмена:
Многокислотные основания могут давать средние и основные соли:
4. Взаимодействуют с кислотными оксидами, образуя средние и кислые соли в зависимости от основности кислоты, соответствующей этому оксиду:

5. Взаимодействуют с амфотерными оксидами и гидроксидами:
а) сплавление:

б) в растворах:

6. Взаимодействуют с растворимыми в воде солями, если образуется осадок или газ:

Нерастворимые основания (Cr(OH) 2 , Mn(OH) 2 и др.) взаимодействуют с кислотами и разлагаются при нагревании:

Амфотерные гидроксиды
Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, т. е. проявлять основные свойства.
Химические свойства амфотерных соединений
1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства:
Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O
2. Взаимодействуя со щелочами - сильными основаниями, они обнаруживают кислотные свойства:
Zn(OH) 2 + 2NaOH = Na 2 ( комплексная соль)
Al(OH) 3 + NaOH = Na ( комплексная соль)
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму.

Общий метод получения оснований базируется на реакциях обмена, с помощью которых могут быть получены как нерастворимые, так и растворимые основания.
CuSО 4 + 2КОН = Cu(OH) 2 ↓ + K 2 SО 4
К 2 СО 3 + Ва(ОН) 2 = 2 КОН + BaCO 3 ↓
При получении этим методом растворимых оснований в осадок выпадает нерастворимая соль.
При получении нерастворимых в воде оснований, обладающих амфотерными свойствами, следует избегать избытка щелочи, так как может произойти растворение амфотерного основания, например:
АlСl 3 + 4КОН = К[Аl(ОН) 4 ] + 3КСl
В подобных случаях для получения гидроксидов используют гидроксид аммония, в котором амфотерные гидроксиды не растворяются:
АlСl 3 + 3NH 3 + ЗН 2 О = Аl(ОН) 3 ↓ + 3NH 4 Cl
Гидроксиды серебра и ртути настолько легко разлагаются, что при попытке их получения обменной реакцией вместо гидроксидов выпадают оксиды:
2AgNО 3 + 2КОН = Ag 2 О↓ + Н 2 О + 2KNO 3
В промышленности щелочи обычно получают электролизом водных растворов хлоридов.
2NaCl + 2Н 2 О → ϟ → 2NaOH + H 2 + Cl 2
Щелочи можно также получить взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой.
2Li + 2Н 2 О = 2LiOH + Н 2
SrO + Н 2 О = Sr(OH) 2

Кислоты
Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. При обычных условиях кислоты могут быть твердыми (фосфорная H 3 PO 4 ; кремниевая H 2 SiO 3) и жидкими (в чистом виде жидкостью будет серная кислота H 2 SO 4).

Такие газы, как хлороводород HCl, бромоводород HBr, сероводород H 2 S, в водных растворах образуют соответствующие кислоты. Числом ионов водорода, образуемых каждой молекулой кислоты при диссоциации, определяется заряд кислотного остатка (аниона) и основность кислоты.
Согласно протолитической теории кислот и оснований, предложенной одновременно датским химиком Брёнстедом и английским химиком Лоури, кислотой называют вещество, отщепляющее при данной реакции протоны, а основанием - вещество, способное принимать протоны.
кислота → основание + Н +
На основе таких представлений понятны основные свойства аммиака, который благодаря наличию неподеленной электронной пары при атоме азота эффективно принимает протон при взаимодействии с кислотами, образуя ион аммония посредством донорноакцепторной связи.
HNO 3 + NH 3 ⇆ NH 4 + + NO 3 —
кислота основание кислота основание
Более общее определение кислот и оснований предложил американский химик Г. Льюис. Он предположил, что кислотно-основные взаимодействия совсем не обязательно происходят с переносом про тона. В определении кислот и оснований по Льюису основная роль в химических реакциях отводится электронным парам.
Катионы, анионы или нейтральные молекулы, способные принять одну или несколько пар электронов, называют кислотами Льюиса.
Так, например, фторид алюминия AlF 3 - это кислота, так как он способен принимать электронную пару при взаимодействии с аммиаком.
AlF 3 + :NH 3 ⇆ :
Катионы, анионы или нейтральные молекулы, способные отдавать электронные пары, называют основаниями Льюиса (аммиак - основание).
Определение Льюиса охватывает все кислотно-основные процессы, которые рассматривались ранее предложенными теориями. В таблице сопоставлены определения кислот и оснований, используемые в настоящее время.

Номенклатура кислот
Поскольку существуют разные определения кислот, их классификация и номенклатура довольно условны.
По числу атомов водорода, способных к отщеплению в водном растворе, кислоты делят на одноосновные (например, HF, HNO 2), двухосновные (H 2 CO 3 , H 2 SO 4) и трехосновные (Н 3 РO 4).
По составу кислоты делят на бескислородные (НСl, H 2 S) и кислородсодержащие (НСlO 4 , HNO 3).
Обычно названия кислородсодержащих кислот производятся от названия неметалла с прибавлением окончаний -кая, -вая, если степень окисления неметалла равна номеру группы. По мере понижения степени окисления суффиксы меняются (в порядке уменьшения степени окисления металла): -оватая, истая, -оватистая:



Если рассмотреть полярность связи водород-неметалл в пределах периода, легко можно связать полярность этой связи с положением элемента в Периодической системе. От атомов металлов, легко теряющих валентные электроны, атомы водорода принимают эти электроны, образуя устойчивую двухэлектронную оболочку типа оболочки атома гелия, и дают ионные гидриды металлов.
В водородных соединениях элементов III-IV групп Периодической системы бора, алюминия, углерода, кремния образуют ковалентные, слабополярные связи с атомами водорода, не склонные к диссоциации. Для элементов V-VII групп Периодической системы в пределах периода полярность связи неметалл-водород увеличивается с зарядом атома, но распределение зарядов в возникающем диполе иное, чем в водородных соединениях элементов, склонных отдавать электроны. Атомы неметаллов, у которых для завершения электронной оболочки необходимо несколько электронов, оттягивают к себе (поляризуют) пару электронов связи тем сильнее, чем больше заряд ядра. Поэтому в рядах СН 4 - NH 3 - Н 2 O - HF или SiH 4 - PH 3 - H 2 S - НСl связи с атомами водорода, оставаясь ковалентными, приобретают более полярный характер, а атом водорода в диполе связи элемент-водород становится более электроположительным. Если полярные молекулы оказываются в полярном растворителе, может происходить процесс электролитической диссоциации.
Обсудим поведение кислородсодержащих кислот в водных растворах. У этих кислот имеется связь Н-О-Э и, естественно, на полярность связи Н-О влияет связь О-Э. Поэтому эти кислоты диссоциируют, как правило, легче, чем вода.
H 2 SO 3 + H 2 O ⇆ H з O + + HSO 3
HNO 3 + H 2 O ⇆ H з O + + NO 3
На нескольких примерах рассмотрим свойства кислородсодержащих кислот, образованных элементами, которые способны проявлять разную степень окисления. Известно, что хлорноватистая кислота НСlO очень слабая, хлористая кислота НСlO 2 также слабая, но сильнее хлорноватистой, хлорноватая кислота НСlO 3 сильная. Хлорная кислота НСlO 4 - одна из самых сильных неорганических кислот.

Для диссоциации по кислотному типу (с отщеплением иона Н) необходим разрыв связи О-Н. Как можно объяснить уменьшение прочности этой связи в ряду НСlO - НСlO 2 - НСlO 3 - НСClO 4 ? В этом ряду увеличивается число атомов кислорода, связанных с центральным атомом хлора. Каждый раз, когда образуется новая связь кислорода с хлором, от атома хлора, а следовательно, и от одинарной связи О-Cl оттягивается электронная плотность. В результате электронная плотность частично уходит и от связи О-Н, которая из- за этого ослабляется.
Такая закономерность - усиление кислотных свойств с возрас танием степени окисления центрального атома - характерна не только для хлора, но и для других элементов. Например, азотная кислота HNO 3 , в которой степень окисления азота +5, более сильная, чем азотистая кислота HNO 2 (степень окисления азота +3); серная кислота H 2 SO 4 (S +6) более сильная, чем сернистая кислота H 2 SO 3 (S +4).
Получение кислот
1. Бескислородные кислоты могут быть получены при непосредственном соединении неметаллов с водородом .
Н 2 + Сl 2 → 2НСl,
H 2 + S ⇆ H 2 S
2. Некоторые кислородсодержащие кислоты могут быть получены взаимодействием кислотных оксидов с водой .
3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакциям обмена между солями и другими кислотами.
BaBr 2 + H 2 SO 4 = BaSO 4 ↓ + 2НВr
CuSO 4 + H 2 S = H 2 SO 4 + CuS↓
FeS + H 2 SO 4(pa зб) = H 2 S+FeSO 4
NaCl (T) + H 2 SO 4(конц) = HCl + NaHSO 4
AgNO 3 + HCl = AgCl↓ + HNO 3
CaCO 3 + 2HBr = CaBr 2 + CO 2 + H 2 O
4. Некоторые кислоты могут быть получены с помощью окислительно-восстановительных реакций.
Н 2 O 2 + SO 2 = H 2 SO 4
3Р + 5HNO 3 + 2Н 2 O = ЗН 3 РO 4 + 5NO 2
Кислый вкус, действие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами - эти свойства являются общими для неорганических и органических кислот.
можно разделить на два типа реакций:
1) общие для кислот реакции связаны с образованием в водных растворах иона гидроксония Н 3 O + ;
2) специфические (т. е. характерные) реакции конкретных кислот.
Ион водорода может вступать в окислителъно-восстановительные реакции, восстанавливаясь до водорода, а также в реакции соединения с отрицательно заряженными или нейтральными частицами, имеющими неподеленные пары электронов, т. е. в кислотно-основные реакции.
К общим свойствам кислот относятся реакции кислот с металлами, стоящими в ряду напряжений до водорода, например:
Zn + 2Н + = Zn 2+ + Н 2
К кислотно-основным реакциям относятся реакции с основными оксидами и основаниями, а также со средними, основными, а иногда и кислыми солями.
2 CO 3 + 4HBr = 2CuBr 2 + CO 2 + 3Н 2 O
Mg(HCO 3) 2 + 2НСl = MgCl 2 + 2СO 2 + 2Н 2 O
2KHSO 3 + H 2 SO 4 = K 2 SO 4 + 2SO 2 + 2H 2 O
Заметим, что многоосновные кислоты диссоциируют ступенчато, причем на каждой следующей ступени диссоциация проходит труднее, поэтому при избытке кислоты чаще всего образуются кислые соли, а не средние.
Са 3 (РO 4) 2 + 4Н 3 РO 4 = 3Са(Н 2 РO 4) 2
Na 2 S + Н 3 РО 4 = Na 2 HPO 4 + H 2 S
NaOH + H 3 PO 4 = NaH 2 PO 4 + Н 2 O
КОН + H 2 S = KHS + Н 2 O
На первый взгляд, может показаться удивительным образование кислых солей одноосновной фтороводородной (плавиковой) кислотой. Однако этот факт можно объяснить. В отличие от всех других галогеноводородных кислот плавиковая кислота в растворах частично полимеризована (благодаря образованию водородных связей) и в ней могут присутствовать разные частицы (HF) X , а именно H 2 F 2 , H 3 F 3 и т. д.
Частный случай кислотно-основного равновесия - реакции кислот и оснований с индикаторами, которые изменяют свою окраску в зависимости от кислотности раствора. Индикаторы используются в качественном анализе для обнаружения кислот и оснований в растворах.
Самые часто применяемые индикаторы - лакмус (в нейтральной среде фиолетовый цвет, в кислой - красный, в щелочной - синий), метилоранж (в кислой среде красный, в нейтральной - оранжевый, в щелочной - желтый), фенолфталеин (в сильнощелочной среде малиново-красный, в нейтральной и кислой - бесцветный).
Специфические свойства различных кислот могут быть двух типов: во-первых, реакции, приводящие к образованию нерастворимых солей, и, во-вторых, окислительно-восстановительные превращения. Если реакции, связанные с наличием у них иона Н + , общие для всех кислот (качественные реакции для обнаружения кислот), специфические реакции используются как качественные на отдельные кислоты:
Ag + + Cl — = AgCl (белый осадок)
Ва 2+ + SO 4 2- = BaSO 4(белый осадок)
3Ag + + PO 4 3 — = Ag 3 PO 4(желтый осадок)
Некоторые специфические реакции кислот обусловлены их окислительно-восстановительными свойствами.
Бескислородные кислоты в водном растворе могут только окисляться.
2КМnO 4 + 16НСl = 5Сl 2 + 2КСl + 2МnСl 2 + 8Н 2 O
H 2 S + Вг 2 = S + 2НВг
Кислородсодержащие кислоты могут окисляться только в том случае, если центральный атом в них находится в низшей или промежуточной степени окисления, как, например, в сернистой кислоте:
H 2 SO 3 + Сl 2 + Н 2 O = H 2 SO 4 + 2НСl
Многие кислородсодержащие кислоты, в которых центральный атом имеет максимальную степень окисления (S +6 , N +5 , Сг +6), проявляют свойства сильных окислителей. Концентрированная H 2 SO 4 - сильный окислитель.
Сu + 2H 2 SO 4(конц) = CuSO 4 + SO 2 + 2Н 2 O
Pb + 4HNO 3 = Pb(NO 3) 2 + 2NO 2 + 2H 2 O
C + 2H 2 SO 4(конц) = CO 2 + 2SO 2 + 2H 2 O
Следует запомнить, что:
- Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли. Взаимодействие HNO 3 и Н 2 SO 4 (конц.) с металлами протекает иначе.

Концентрированная серная кислота на холоде пассивирует алюминий, железо, хром.
- В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:

- Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
- И те, и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовывать как средние, так и кислые соли (это реакции нейтрализации):

- Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ:

Взаимодействие H 3 PO 4 с известняком прекратится из-за образования на поверхности последнего нерастворимого осадка Ca 3 (PO 4) 2 .
Особенности свойств азотной HNO 3 и концентрированной серной H 2 SO 4 (конц.) кислот обусловлены тем, что при их взаимодействии с простыми веществами (металлами и неметаллами) окислителями будут выступать не катионы H + , а нитрат- и сульфат-ионы. Логично ожидать, что в результате таких реакций образуется не водород H 2 , а получаются другие вещества: обязательно соль и вода, а также один из продуктов восстановления нитрат- или сульфат-ионов в зависимости от концентрации кислот, положения металла в ряду напряжений и условий реакции (температуры, степени измельченности металла и т. д.).
Эти особенности химического поведения HNO 3 и H 2 SO 4 (конц.) наглядно иллюстрируют тезис теории химического строения о взаимном влиянии атомов в молекулах веществ.

Часто путают понятия летучесть и устойчивость (стабильность). Летучими называют кислоты, молекулы которых легко переходят в газообразное состояние, то есть испаряются. Например, соляная кислота является летучей, но устойчивой, стабильной кислотой. О летучести нестабильных кислот судить нельзя. Например, нелетучая, нерастворимая кремниевая кислота разлагается на воду и SiO 2 . Водные растворы соляной, азотной, серной, фосфорной и ряда других кислот не имеют окраски. Водный раствор хромовой кислоты H 2 CrO 4 имеет желтую окраску, марганцевой кислоты HMnO 4 - малиновую.
Справочный материал для прохождения тестирования:
Таблица Менделеева
Таблица растворимости
Калия, натрия или лития, могут взаимодействовать с водой. В этом случае в продуктах реакции обнаруживаются соединения, относящиеся к гидроксидам. Свойства этих веществ, особенности протекания химических процессов, в которых участвуют основания, обусловлены присутствием в их молекулах гидроксильной группы. Так, в реакциях электролитической диссоциации основания расщепляются на ионы металла и анионы OH - . Как основания взаимодействуют с оксидами неметаллов, кислотами и солями, мы и рассмотрим в нашей статье.
Номенклатура и строение молекулы
Чтобы правильно назвать основание, требуется к названию металлического элемента прибавить слово гидроксид. Приведем конкретные примеры. Основание алюминия относится к амфотерным гидроксидам, свойства которых мы рассмотрим в статье. Обязательное присутствие в молекулах оснований гидроксильной группы, связанной с катионом металла ионным типом связи, можно определить с помощью индикаторов, например, фенолфталеина. В водной среде избыток ионов OH - определяется по изменению цвета раствора индикатора: бесцветный фенолфталеин становится малиновым. Если металл проявляет несколько валентностей, он может образовывать несколько оснований. Например, железо имеет два основания, в которых равна 2 или 3. Первое соединение характеризуется признаками второе - амфотерных. Поэтому свойства высших гидроксидов отличаются от соединений, в которых металл имеет низшую степень валентности.

Физическая характеристика
Основания - это твердые вещества, устойчивые к нагреванию. По отношению к воде они делятся на растворимые (щелочи) и нерастворимые. Первая группа образована активными в химическом отношении металлами - элементами первой и второй групп. Нерастворимые в воде вещества состоят из атомов других металлов, чья активность уступает натрию, калию или кальцию. Примерами таких соединений могут служить основания железа или меди. Свойства гидроксидов будут зависеть от того, к какой группе веществ они относятся. Так, щелочи являются термически прочными и не разлагаются при нагревании, тогда, как нерастворимые в воде основания под действием высокой температуры разрушаются, образуя оксид и воду. Например, основание меди разлагается следующим образом:
Cu(OH) 2 = CuO + H 2 O

Химические свойства гидроксидов
Взаимодействие между собой двух важнейших групп соединений - кислот и оснований - именуют в химии реакцией нейтрализации. Такое название можно объяснить тем, что химически агрессивные гидроксиды и кислоты образуют нейтральные продукты - соли и воду. Являясь, по сути, обменным процессом между двумя сложными веществами, нейтрализация характерна как для щелочей, так и для нерастворимых в воде оснований. Приведем уравнение реакции нейтрализации между едким калием и хлоридной кислотой:
KOH + HCl = KCl + H 2 O
Важное свойство оснований щелочных металлов является их способность реагировать с кислотными оксидами, в результате можно получить соль и воду. Например, пропуская через гидроксид натрия углекислый газ, можно получить его карбонат и воду:
2NaOH + CO 2 = Na 2 CO 3 + H 2 O
К реакциям ионного обмена относится взаимодействие между щелочами и солями, идущее с образованием нерастворимых гидроксидов или солей. Так, приливая по каплям раствор в раствор сернокислой меди, можно получить голубой желеобразный осадок. Это основание меди, нерастворимое в воде:
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4
Химические свойства гидроксидов, нерастворимых в воде, отличаются от щелочей тем, что они при небольшом нагревании теряют воду - дегидратируются, переходя в форму соответствующего основного окисла.
Основания, проявляющие двойственные свойства
Если элемент или может реагировать и с кислотами, и с щелочами - его называют амфотерным. К таковым относятся, например, цинк, алюминий и их основания. Свойства амфотерных гидроксидов позволяют записывать их молекулярные формулы как в выделяя при этом гидроксогруппу, так и в виде кислот. Представим несколько уравнений реакций основания алюминия с хлоридной кислотой и гидроксидом натрия. Они иллюстрируют особые свойства гидроксидов, относящихся к амфотерным соединениям. Вторая реакция проходит с распадом щелочи:
2Al(OH) 3 + 6HCl = 2AlCl 3 + 3H 2 O
Al(OH) 3 + NaOH = NaAlO 2 + 2H 2 O
Продуктами процессов будут вода и соли: хлорид алюминия и алюминат натрия. Все амфотерные основания не растворяются в воде. Добывают их в результате взаимодействия соответствующих солей и щелочей.
Способы получения и применение
В промышленности, требующей больших объемов щелочей, их получают электролизом солей, содержащих катионы активных металлов первой и второй группы периодической системы. Сырьем для добычи, например, едкого натрия, служит раствор поваренной соли. Уравнение реакции будет таким:
2NaCl + 2H 2 O = 2NaOH + H 2 + Cl 2
Основания малоактивных металлов в лаборатории получают взаимодействием щелочей с их солями. Реакция относится к типу ионного обмена и заканчивается выпадением осадка основания. Простой способ получения щелочей - это реакция замещения, проходящая между активным металлом и водой. Она сопровождается разогреванием реагирующей смеси и относится к экзотермическому типу.

Свойства гидроксидов используют в промышленности. Особую роль здесь играют щелочи. Их применяют в качестве очистителей керосина и бензина, для получения мыла, обработки натуральной кожи, а также в технологиях производства искусственного шелка и бумаги.
ГИДРОКСИДЫ, неорганические соединения металлов общей формулы М(OH)n, где М металл, n его степень окисления. Гидроксиды основания или амфотерные (обладают кислотными и основными свойствами) соединения, гидроксиды щелочных и щелочно земельных… … Современная энциклопедия
Химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин гидроксид относится только к основаниям. См.… … Большой Энциклопедический словарь
ГИДРОКСИДЫ, неорганические химические соединения, содержащие ион ОН, проявляющие свойства ОСНОВАНИЙ (веществ, присоединяющих протоны и реагирующих с кислотой, образующих при этом соль и воду). Сильные неорганические основания, такие как… … Научно-технический энциклопедический словарь
ГИДРОКСИДЫ - хим. соединения (см.) с водой. Г. многих металлов (см.), а неметаллов (см.). В формуле основания на первом месте ставится хим. символ металла, на втором кислорода и на последнем водорода (гидроксид калия КОН, гидроксид натрия NaOH и др.). Группа… … Большая политехническая энциклопедия
Химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин «гидроксиды» относится только к основаниям … Энциклопедический словарь
Неорг. соед. металлов общей ф лы М(ОН)n, где и степень окисления металла М. Являются основаниями или амфотерными соединениями. Г. щелочных, щел. зем. металлов и Тl(I) наз. щелочами, Кристаллич. решетки Г. щелочных и щел. зем. металлов содержат… … Химическая энциклопедия
Неорганич. соединения, содержащие одну или неск. групп ОН. Могут быть основаниями или амфотерными соединениями (см. Амфотерность). Г. встречаются в природе в виде минералов, например гидраргиллит А1(ОН)3, брусит Mg(OH)2 … Большой энциклопедический политехнический словарь
Хим. соед. оксидов с водой. Г. мн. металлов основания, а неметаллов кислоты. Г., проявляющие как основные, так и кислотные свойства, наз. амфотерными. Обычно термин Г. относится только к основаниям. См. также Щёлочи … Естествознание. Энциклопедический словарь
гидроксиды - гидрокс иды, ов, ед. ч. с ид, а … Русский орфографический словарь
гидроксиды - мн., Р. гидрокси/дов; ед. гидрокси/д (2 м) … Орфографический словарь русского языка
Книги
- Химия. Учебник для академического бакалавриата , Зайцев О.С.. При раскрытии курса особое внимание уделено вопросам термодинамики и кинетики химических реакций. Впервые представлены вопросы новой области химических знаний, крайне важной для специалистов…
- Неорганическая и аналитическая химия скандия , Л. Н. Комиссарова. В монографии обобщены сведения об основных группах неорганических соединений скандия (интерметаллиды, бинарные бескислородные соединения, в том числе галогенидыи роданиды, сложные оксиды,…
Гидроксиды - это электролит при диссоциации которого в водных растворах образуется катион металла и отрицательно заряженный гидроксид анион.
Гидроксиды кроме: оснований щелочных и щелочноземельных металлов, а также амфотерных гидроксидов - практически нерастворимы в воде.
Основные гидроксиды (основания ) - только гидроксиды металлов со степенью окисления +1, +2
А М Ф О Т Е Р Н Ы Е. Г И Д Р О К С И Д Ы.
Амфотерные гидроксиды - это гидроксиды которые при диссоциации в водных растворах могут образовывать как H + так и OH -
Амфотерные гидроксиды , гидроксиды металлов со степенью окисления +3, +4 и нескольких металлов со степенью окисления +2
Свойства:
1. Амфотерные гидроксиды реагируют со щелочами.
2. Амфотерные гидроксиды реагируют с кислотами.
К И С Л О Т Н Ы Е. Г И Д Р О К С И Д Ы.
Кислотные гидроксиды - гидроксиды, проявляющие свойства кислот - HNO 3 , H 3 PO 4
Свойства:
Свойства кислотных гидроксидов соответственно обратные свойствам щелочных гидроксидов.
Вопрос 18
Вопрос 19 (см. 11 вопрос!!)
Вопрос 20
Понятие функции состояния. Примеры.
Функция состояния системы – некая аналитическая функция, которая зависит от термодинамических параметров системы в данном состоянии. Значение не зависит от предыстории системы, а при переходе из одного состояния в другое не зависит от пути процесса. Определяется лишь начальным и конечным состоянием системы.
∆U 1,2 =U 2 -U 1
Вопрос 21
Соли. Классификация. Структурные формулы. Получение.
Соли:
Кислые 2) Средние 3) Основные
Средняя соль - это электролит при диссоциации которого в водном растворе образуется катион металла и анион кислотного остатка
Условия получения средней соли
H 2 CO 2 +2NaOH=2Na 2 CO 3 +2H 2 O
Средняя соль образуется в том случае когда реакция протекает в строго стехеометрических соотношениях
Кислая соль - это элемент при диссоциации которого образуется катион металла, катион водорода и анион кислотного остатка
Условия получения кислых солей
H 2 CO 3 +NaOH=NaHCO 3 +H 2 O
Кислые соли получается при избытке кислорода.
Основные соли - это электролит при диссоциации которого образуется катион металла гидроксид анион и анион кислотного остатка
Получение:
Кислота + основание
Кислота + основный оксид
кислота + соль
соль + соль
Основание + кислотный оксид
щелочь + соль
основный оксид + кислотный оксид
металл + неметалл
металл + кислота
металл + соль
Вопрос 22
Энтальпия и энтропия образования химических веществ.
Энтропия - функция состояния системы которая показывает направление протекания процессов в природе. Мера хаотичности и неупорядоченности системы.
Энтальпия является мерой энергии, накапливпемой веществом при его образовании
Когда энтропия максимальна, энтальпия минимальна и наоборот.
Вопрос 23
Типы хим. связей.
Электроотрицательность – способность атомов оттягивать на себя электронную плотность.
Ковалентная связь – двухатомная связь, 2 атома и 2 электрона обазательных. (сильная связь, локализованная)
Ионная связь – предельный случай ковалентной полярной связи; электростатическое взаимодействие которое возникает между катионами и анионами.
Универсальная связь – вандервальсовыемежмолекулярные
Специфические
1) Металлическая. Все электроны образуют электронный газ
2) Водородная связь. Основана на свойстве атомов H, связанного сильно электроотрицательным элементом.
Вопрос 24.